Pravilo vzvoda
- 1523
- 215
- Don Nitzsche
Kaj je pravilo vzvoda?
The pravilo vzvoda Gre. Ne samo, da je matematična, ampak tudi precej grafična in asertivna, saj je zelo uporaben pri fizikalno -kemijskih in inženirskih izračunih.
To pravilo velja za fazne diagrame za binarne sisteme, ne glede na vrsto samega sistema. To pomeni, da so faze lahko trdne, kot pri zlitinah; ali tekočina in plinasta, kot vidimo v sistemih v ravnotežju tekočine in hlapov.
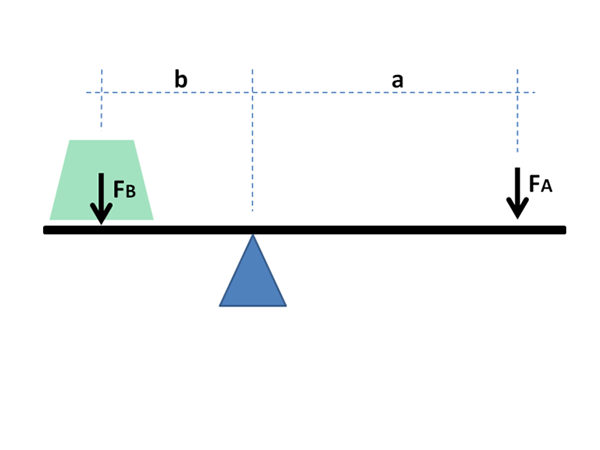
 Fizikalno in matematično načelo ročice se uporablja tudi v kemijske namene in v fiziki materialov. Vir: Jimbowley, CC BY-SA 3.0, prek Wikimedia Commons
Fizikalno in matematično načelo ročice se uporablja tudi v kemijske namene in v fiziki materialov. Vir: Jimbowley, CC BY-SA 3.0, prek Wikimedia Commons Pravilo ročice je mogoče uporabiti neposredno ob upoštevanju vrednosti grafike v osi abscisa, kjer se v primeru tekočin običajno dogajajo globalne frakcije ali odstotki najbolj hlapne komponente; ali ognjevzdržno, v primeru kovin v njihovih zlitinah.
Kot bo razvidno spodaj, je njegovo ime posledica neizmerne podobnosti, ki jo ima z matematičnimi izrazi, ki prikazujejo ravnovesje med dvema masama, ki se nahajata na koncih rockerja s Fulcro.
Ročice ročice morajo uravnotežiti, da uravnotežijo množice obremenitev; V primeru faznih diagramov, frakcij in molov faz v ravnovesju materiala.
Pojasnilo
Grafični vidiki
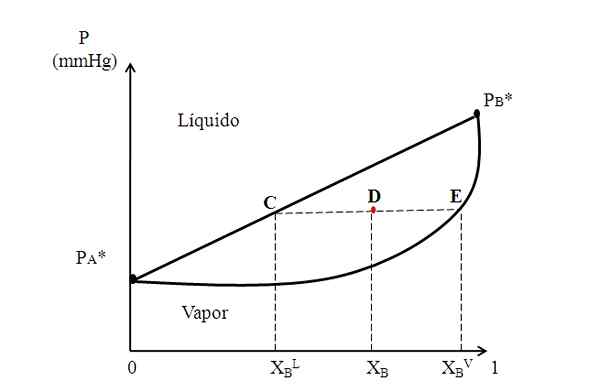 Hipotetični binarni diagram, kjer vezivna črta prikazuje sestave tekoče in pare faze. Vir: Gabriel Bolívar.
Hipotetični binarni diagram, kjer vezivna črta prikazuje sestave tekoče in pare faze. Vir: Gabriel Bolívar. Sredi zgornjega diagrama imamo območje, kjer soobstajajo tekočino in paro; to pomeni, da je ravnotežno območje tekočine-vrednosti. Nad tem območjem bo mešanica A in B tekoča, pod njim pa bo soda zaradi nižjih tlakov.
Zdaj razmislite o mešanici s kompozicijo xB in čigar tlak ga postavi v točki D. Iz točke D črpamo vodoravno črto, ki se dotakne črte in krivulje na straneh, s katerimi je izvirala C in E. Ta vrstica, ki sporoča točke C, D in E, C-D-E, je tista, ki je znana kot linija zveze, in s tem, da jo projicira proti osi, in nam mora dati pritisk sistema.
Lahko vam služi: vodna alkalnost: kaj je, odločnost in pomenNato iz teh točk narišemo druge črte, pravokotne na vezivno črto, ki bodo igrale osi x. Ko točka E počiva na krivulji pare, bomo imeli molski del B v parni fazi (xBV). Prav tako nam bo točka C na ravni črti tekočine dala molarni delež B v tekoči fazi (xBL).
Pravilo ročice temelji natančno na zavezujoči črti in razdaljah med xBL, XB in xBV.
Matematični odbitek
Globalni molarni del B je enak:
XB = nB / (nL + nV)
Kje nB So skupni moli B tako v fazi tekočine kot v pari, in nL in nV so ustrezni moli za te faze. Čiščenje nB bomo imeli:
nB = XBnL + XBnV (1)
Po drugi strani, nB Enako je tudi:
nB = nBL + nBV
= XBLnL + XBVnV (2)
Zdaj nam bo dalo izenačenje enačb (1) in (2):
XBnL + XBnV = XBLnL + XBVnV
In preureditev:
nL(XB - XBL) = nV(XBV - XB) (3)
nL(C-d) = nV()
Ta zadnji dve matematični izrazi sta pravilo vzvoda. Upoštevajte, da je xB - XBL To je razdalja med točkami C in D; in xBV - XB, To je razdalja med točkami D-E: dve polovici vezavne črte (ročice ročice).
Ta enačba je zelo podobna tisti, ki opisuje ravnovesje mas na rockerju s Fulcro:
m1l1 = m2l2
Tako nam bo pravilo ročice omogočilo izračun skupnih molov nL in nV pod pogojem, da so znani skupni moli mešanice, nT (nT = nL + nV).
Drugi obrazec
Prejšnji izraz za pravilo ročice služi za izračun količin (mase, molov itd.) faz v ravnotežju. Vendar nam najbolj znana različica pravila o ročici omogoča izračun ulomkov ali odstotkov vsake faze, pri čemer vzamemo samo razdalje med xB, XBL in xBV.
Razmislite o istem sistemu zgoraj, z drugo obliko pravila o ročici:
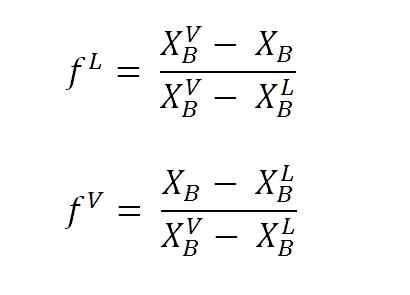 Enačbe za izračun tekočih in parnih frakcij z ročico ročice. Vir: Gabriel Bolívar.
Enačbe za izračun tekočih in parnih frakcij z ročico ročice. Vir: Gabriel Bolívar. Kje F L in F VSo molarne frakcije (ali odstotek, odvisno od grafa) tekočine in hlapov. Upoštevajte, da očitno, F L in F V Nimajo enot; medtem nL in nV Da, imajo enote (moli, grami itd.).
Vam lahko služi: reakcijska toplotaPrimeri
Metoda 1
V posodi je 28 molov B in 12 molov A. Določite količine in molarne frakcije za oblikovane faze.
Izračunamo xB:
XB = (28 molov B)/ (28 molov B + 12 molov a)
= 0.7
Ta vrednost ustreza xB zgornjega diagrama. Prestrezanja nam bodo dali približno naslednje vrednosti za xBL in xBV:
XBL = 0.41
XBV = 0.94
S pravilom ročice:
nL(XB - XBL) = nV(XBV - XB)
In to vedo nT = nL + nV, In? nT = 40 molov, potem se očistimo nL tudi nV Odvisno od drugega:
nL(XB - XBL) = (40 molov - nL) (XBV - XB)
Preureditev in čiščenje nL bomo imeli:
nL = (40 molov) (xBV - XB) / (XBV - XBL)
Ali se ta izraz ne spomni F L? Zdaj bomo zamenjali:
nL = (40 molov) (0.94 - 0.70) / (0.94 - 0.41)
= 18.11 molov v tekoči fazi
Lahko izračunamo nV Na dva načina:
nV = nL(XB - XBL) / (XBV - XB)
tudi
nV = 40 molov - 18.11 molov
= 21.89 molov v parni fazi
Metoda 2
Kaj pa, če najprej izračunamo F L in F V?
F L = (XBV - XB) / (XBV - XBL)
= (0.94 - 0.70) / (0.94 - 0.41)
= 0.4528 ali 45.28%
To je 45.2% molov je v tekoči fazi, saj je ta količina enaka:
nL = F LnT
= (0.4528) (40 molov)
= 18.11 molov
In F V Lahko ga izračunamo enako na dva načina:
F V = 1 - F L
tudi
F V = (XB - XBL) / (XBV - XBL)
Je njegova vrednost:
F V = 0.5472 ali 54.72%
In zato, nV Enako bo:
nV = F VnT
= (0.5472) (40 molov)
= 21.89 molov
Upoštevajte, da lahko uporaba obeh oblik pravila ročice kot alternativne metode izračuna dosežemo enake rezultate. Metoda 2 se zdi bolj neposredna in preprosta; Če pa ga opazimo previdno, ko se čiščenje reši nL tudi nV, Videti bo, da sta obe metodi dejansko enako enostavni.
Rešene vaje
Nato bosta rešena še dve vaji, kjer bodo zdaj obravnavani sistemi vključevali tekočino in nerešeno-hlap. Tudi diagrami so grafični glede na temperaturo sistema in ne njihovega tlaka.
Vaja 1
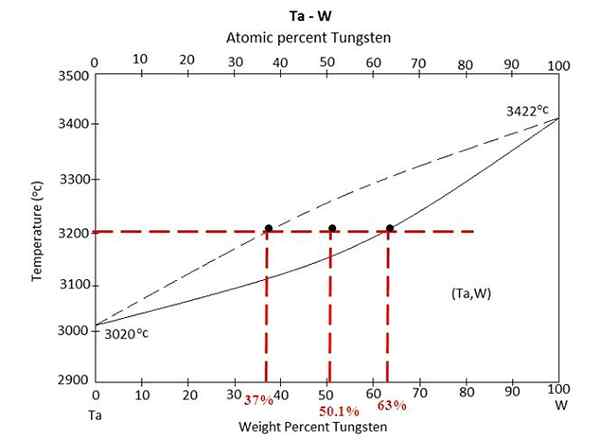 Fazni diagram za zlitino med Tantalom in volframom. Vir: MaterialSpedia, CC BY-SA 4.0, prek Wikimedia Commons
Fazni diagram za zlitino med Tantalom in volframom. Vir: MaterialSpedia, CC BY-SA 4.0, prek Wikimedia Commons Fazni diagram imamo nad zlitino med Tantalo in volframo, TA-W. Na osi x so zastopani globalni masni odstotki volframa, W% (m/m).
Znotraj tekočega ravnotežnega območja (TA+W) in trdno (zlitino) je mešanica pri 3200 ° C. Določite mase vsake faze ob predpostavki, da se je segrelo 100 gramov zlitine.
Lahko vam služi: kovine, ne -kovine in metaloidiPostopek
Tokrat bo vaja rešena z drugo obliko pravila ročice. Linija Unije nam pove, da: v trdni fazi imamo 63% volframa, v tekoči fazi. To je zato, ker se volfram topi na višjo temperaturo (3422 ° C) kot tantal (3020 ° C).
Torej, imamo:
W%S ali wS= 63%
W%L ali wL= 37%
In tudi:
W0 = 50.1%
Pravilo ročice uporabimo za F L:
F L = (63% - 50.1%) / (63% - 37%)
= 0.4961 ali 49.61%
Upoštevajte, da je razdalja, ki ustreza tekoči fazi, ročica ročice blizu trdne faze, nasprotna stran srednje točke.
Masa tekoče faze je torej:
(0.4961) (100 gramov) = 49.61 staljenih gramov
In trdna faza bo enaka:
100 gramov - 49.61 gramov = 50.39 gramov zlitine, bogate z volframom
Vaja 2
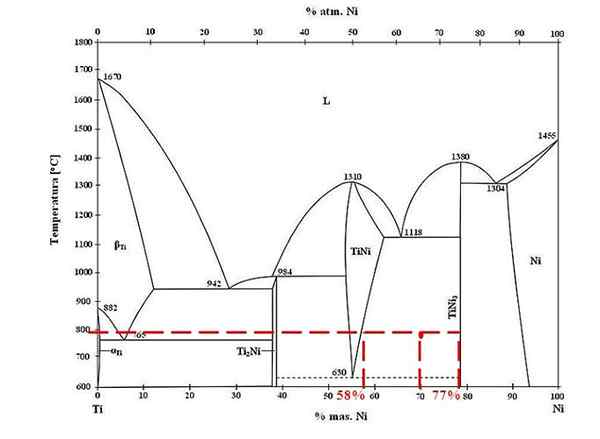 Fazni diagram za zlitine titanov-niklja. Vir: Doomgiver, CC BY-SA 3.0, prek Wikimedia Commons
Fazni diagram za zlitine titanov-niklja. Vir: Doomgiver, CC BY-SA 3.0, prek Wikimedia Commons Za titanovo in nikljevo zlitino pri 800 ° C in s 70% niklja določite, koliko tini in tini3 so prisotni.
Postopek
Tokrat zahtevajo le masne frakcije vsake faze. Rdeča točka se nahaja v ravnotežnem območju med fazo tini in tini3, katerih krivulje je tam, kjer igra linijo Unije, ki teče na vrednosti 58% ali za fazo tini, in 77% ali za fazo tini3.
Upoštevajte, da je rdeča točka bližje fazi tini3 tisto od faze tini. To pomeni, da mora biti več tini3 ta tini; In zato razdalja ali ročica ročice, ki ustreza tini3 Mora biti najdaljša, nasprotna (70%-58%).
Če to vemo, nadaljujemo z izračunom F Tini3:
F Tini3 = (70% - 58%) / (77% - 58%)
= 0.6316 ali 63.16%
Dejansko, 63.16% zlitine ustreza fazi tini3. Medtem faza tini ustreza:
1 = F Tini3 + F Tini
F Tini = 1 - F Tini3
= 0.3684 ali 36.84%
Za zaključek dvignjenih vaj lahko rečemo, da je pravilo ročice zelo koristno za določitev frakcij vsake faze v ravnovesju za dva komponenta.
Reference
- Walter J. Moore. (1963). Fizikalna kemija. V kemični kinetiki. Četrta izdaja, Longmans.
- Iran. Levine. (2009). Načela fizikalnokemije. Šesta izdaja. MC Graw Hill.
- Wikipedija. (2020). Pravilo vzvoda. Pridobljeno iz: v.Wikipedija.org
- Michael Adewumi. (18. maja 2020). Pravilo ročice. Okreval od: eng.Librettexts.org
- Adam Warren. (1997). Fazni diagrami: kravate in pravilo ročice. Okreval od: Southampton.AC.Združeno kraljestvo
- Univerza v Cambridgeu. (2020). Pravilo ročice. Pridobljeno iz: doitpoms.AC.Združeno kraljestvo

