Pravilo potovanja ali največja množica

- 801
- 55
- Don Nitzsche
Pojasnjujemo, kaj je pravilo Hund ali načelo največje množice, koraki za njegovo uporabo in navesti več primerov
 Vir: Gabriel Bolívar
Vir: Gabriel Bolívar Kaj je pravilo umivalnika?
The Pravilo umivalnika, Imenovano tudi načelo maksimalne množice, je empirično pravilo, ki se uporablja za pisanje absolutne elektronske konfiguracije kemičnih elementov, ko so v svojem temeljnem stanju. Se pravi pravilo, ki pomaga napovedati, kako se elektroni porazdelijo v atomske orbitale atoma, ki je sproščen ali na najnižji ravni energije.
Pravilo Sintra pravi:
"… V atomu, ki je v svojem temeljnem stanju, bodo elektroni iste energijske ravni razporejeni tako, da je čim več vzporednih bodic.".
To pravilo ustreza enemu temeljnih načel kvantne mehanike in trenutne atomske teorije. Zelo koristno je razumeti nekatere lastnosti različnih elementov, zlasti njihovih magnetnih lastnosti. To je zato, ker magneti privlačijo ali odbijajo atome, saj so v svoji strukturi izginili elektrone.
Od kod izhaja pravilo pomivalnega korita ali največje večje?
Atomski spektri
To načelo je leta 1927 najprej nakazalo nemškega fizika Friedricha Hunda. Umir je preučeval atomske absorpcijske spektre, ki omogočajo eksperimentalno merjenje energije, ki jo elektroni absorbirajo, ko so izpostavljeni elektromagnetnemu sevanju ustrezne valovne dolžine. Eksperimentalna opazovanja je mogoče razložiti le, če je atom imel čim več elektronov z istim spin.
Manjkajoči elektroni
Poleg atomskih spektrov obstajajo tudi druga eksperimentalna opažanja, ki potrjujejo elektronske konfiguracije, ki jih napovedujemo z uporabo pravila Hund. Najpomembnejše je eksperimentalne ukrepe magnetnih lastnosti atomov, ki omogočajo določitev, koliko manjkajočih elektronov ima atom.
Lahko vam služi: vodna elektrolizaManjkajoči elektroni so tisti, ki so sami v orbitali, brez svojega nasprotnega vrtenja.
Koraki za uporabo pravila umivalnika
Pravilo umivalnika velja, ko v njenem temeljnem stanju napišemo elektronsko konfiguracijo atoma. To pomeni, da gre za dopolnilno pravilo drugih pravil, na primer načelo AUFBAU ali načelo gradnje (imenovano tudi pravilo dežja) in načelo izključitve Paulija.
Velja samo za tiste primere, v katerih želimo.
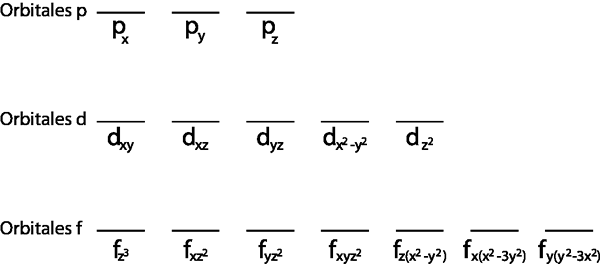
Poleg tega je smiselno uporabiti le za plast Valencije, to je tista raven energije, ki je nepopolna (nima vseh elektronov, ki se v njej prilegajo). V nasprotnem primeru bi bili vsi elektroni seznanjeni z načelom izključitve Paulija.
Uporaba tega pravila je sestavljena iz naslednjih korakov:
- 1. korak: Narišite vodoravno črto ali majhen pravokotnik za vsako orbitalo pod -ravni.
- 2. korak: Prvi elektron postavite v prvi orbital s svojim vrtenjem.
- 3. korak: V naslednjem orbitalu postavite naslednji elektron, ki kažejo tudi navzgor.
- 4. korak: Nadaljujte tako, dokler elektroni niso konec ali ni več praznih orbital.
- 5. korak: Če pri namestitvi elektrona v vsako orbitalo še vedno obstajajo elektroni, ki jih je treba razdeliti, ponovite korake od 2 do 4, vendar postavite elektrone z njihovim vrtenjem navzdol.
Da bi razumeli, kako veljajo ti koraki, analiziramo nekaj primerov.
Primer 1: Elektronska konfiguracija dušika
Nitrogen je element številka 7, tako da ima skupno 7 elektronov, ki se vrtijo okoli jedra. Ti elektroni so po pravilu dežja razporejeni na naslednji način:
Vam lahko služi: acetanila (c8h9no)1s2 2s2 2 p3
Kot lahko vidimo, dušikova valenčna plast ustreza stopnji 2 energije (imenovane plast l), v kateri se prilega 8 elektronov. Vendar ima dušik samo 5 Valencia elektronov.
V orbitalih s Samo 2 elektrona ustrezata, zato je 2S orbitala popolnoma polna in nima smisla uporabiti pravila umivalnika za to orbitalo.
Po drugi strani 2p sub -ravni, ki vsebuje 3 orbitale, ni poln. Kako pa so ti 3 elektroni razporejeni v teh treh orbitalih? Razdeljeni so po korakih pravila umivalnika, ki so predstavljeni spodaj:
1. korak: Narišite vodoravno črto ali majhen pravokotnik za vsako orbitalo pod -ravni.
Ker gre za 2p pod -ravni, obstajajo tri orbitale, ki so 2px, 2 pin in 2pz. Torej moramo narisati tri vodoravne črte ali tri škatle ali pravokotnike:
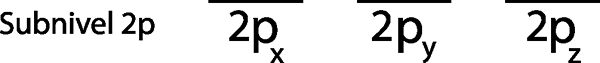
Vsak od teh trakov ali škatel predstavlja orbital, kot je navedeno z imenom, ki ima vsako od njih.
2. korak: Prvi elektron postavite v prvi orbital s svojim vrtenjem.
Prvi elektron postavimo v orbitalo 2Px Ker je to prva orbitala na seznamu.
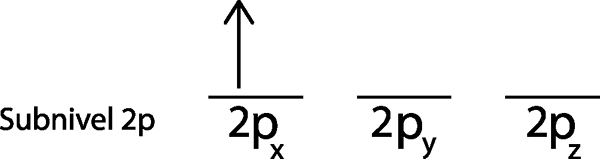
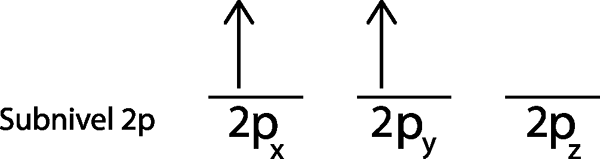
3. korak: V naslednjem orbitalu postavite naslednji elektron, ki kažejo tudi navzgor.
Drugi elektron se nahaja v orbitalu 2Pin
4. korak: Nadaljujte tako, dokler elektroni niso konec ali ni več praznih orbital.
V našem primeru moramo samo distribuirati 3 elektrone, zato moramo zadnjega elektrona namestiti v zadnjo orbitalo in voilo:
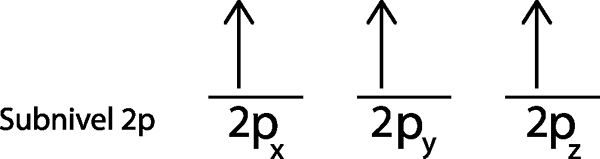
Kot je razvidno, načelo največje množice ali pravila potovanja napoveduje, da mora atomski dušik imeti 3 manjkajoče elektrone.
Vam lahko služi: dušikovi oksidi (NOX)V tem primeru ni bilo treba uporabiti korak 5., saj smo po koraku 4. pustili brez elektronov za distribucijo.
Primer 2: železna elektronska konfiguracija
Iron je element 26 in njegova elektronska konfiguracija je:
1s2 2s2 2 p6 3s2 3P6 3D6 4s2
V tem primeru lahko ugotovimo, da je orbitala z najvišjo energijsko raven 4S, a ker gre za prehodno kovino, ima železo delno polno orbitalo d. To je orbital, katere elektrone bomo distribuirali po pravilu Hund.
1. korak: Narišite vodoravno črto ali majhen pravokotnik za vsako orbitalo pod -ravni.
Napolnili bomo 3D -nivo, ki vsebuje 5 orbital:
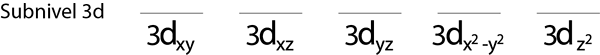
2. korak: Prvi elektron postavite v prvi orbital s svojim vrtenjem.
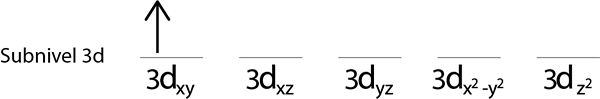
Korak 3: Naslednji elektron postavite v naslednjo orbitalo, ki kaže tudi navzgor.
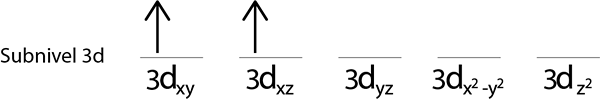
4. korak: Nadaljujte tako, dokler elektroni niso konec ali ni več praznih orbital.
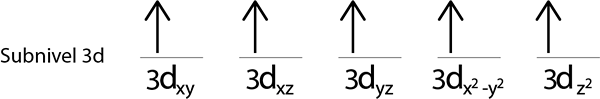
5. korak: Če pri namestitvi elektrona v vsako orbitalo še vedno obstajajo elektroni, ki jih je treba razdeliti, ponovite korake od 2 do 4, vendar postavite elektrone z njihovim vrtenjem navzdol.
Ker imamo še vedno elektron za distribucijo po namestitvi elektrona v vsako 3D orbitalo, je zadnji od 6 elektronov postavljen z nasprotnim vrtenjem v prvi orbitali.
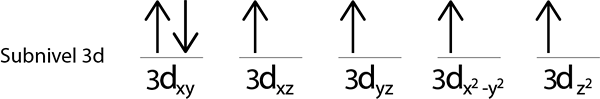
To je absolutna konfiguracija železovega atoma v svojem temeljnem stanju. V istem ima Iron 4 manjkajoče elektrone z vzporednimi bodicami.
Reference
- Brez odgovorov o vprašanjih o največji večkratni pravili ali pravilu potovanja: kaj je treba storiti (2020). Vzeti iz fizike in kvalifikacije.com.
- Umivalnik - kemija (2021). Vzeti iz stroškov.org.
- Največja množica SIND (2020). Vzeti iz principiode.com.
- Pravilo umivalnika | Vodnik za kemijo (2012). Vzeti iz kemije.Laguia2000.com.

