Zmanjšanje (kemija)
- 1001
- 21
- Lee Farrell
 Zmanjšanje srebrnega drevesa. Vir: Gabriel Bolívar
Zmanjšanje srebrnega drevesa. Vir: Gabriel Bolívar Kakšno je zmanjšanje?
The zmanjšanje Vse kemična reakcija je, kjer atomi enega od reagentov na koncu pridobijo elektrone, kar je mogoče videti tudi na ta način: njegovo prosto delovno mesto ali elektronsko "nelagodje" se zmanjša. Atom pridobi elektrone, ko jih vrsta podari, to je, ko oksidira.
Te vrste reakcije ni mogoče dati sama: če vrsta sprejme elektrone, jih mora nujno dati. V nasprotnem primeru bi bila zadeva ustvarjena iz nič, zmanjšala atome po pridobitvi praznih elektronov. Zato gre za redox pol -luč (zmanjšanje/oksidacija).
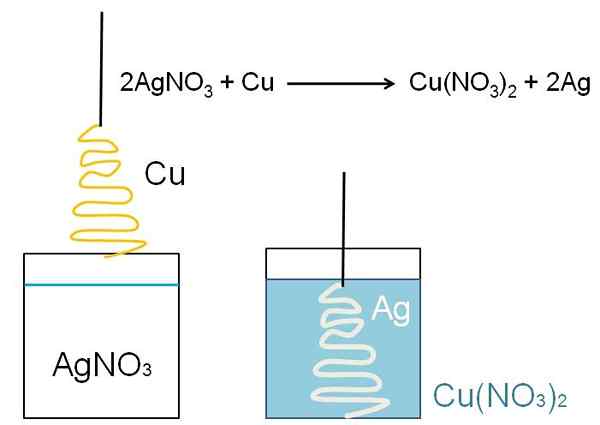
Ponazorni primer zmanjšanja, ki ga je mogoče prikazati v učilnicah razreda, je reakcija med kovinsko bakreno površino in vodno raztopino srebrnega nitrata, Agno3.
V raztopini je srebro kot kationi ag+, pozitivno naloženo. Te, pri interakciji s površino bakra, v obliki božičnega drevesa, se elektroni odvzamejo iz bakrenih atomov. Ko se to zgodi, baker nadomesti srebro v nitratni soli in posledično nastane bakreni nitrat, ne3)2.
Cu Cations2+ Zraven št3- Raztopino modrikamo in srebro uteleša božično drevo, kot da ga pokriva s snegom.
Kakšno je zmanjšanje?
Pri zmanjšanju je že bilo rečeno, da vrsta pridobi elektrone. Kako je to mogoče preveriti v kemični enačbi? Na primer v reakcijski enačbi med Cu in Agno3, Kako vedeti, kdaj se zgodi zmanjšanje? Za preverjanje je treba določiti število ali stanje oksidacije.
Vam lahko služi: elektronegativnostElementi imajo v svojih naravnih stanjih kot opredelitev stanje oksidacije, ki je enako ničli, saj se domneva, da niso izgubili ali osvojili elektronov. Tako imajo trdne kovine nič oksidacijskega stanja. Tako srebro prehaja iz +1 (ag+) A 0 (Ag). Obremenitev kovinskega iona je enaka njegovemu oksidacijskemu stanju.
Po drugi strani so elektroni prišli iz bakra: premikanje od 0 (Cu) na +2 (Cu2+). Nitratni anion, ne3- ostaja nesprejemljivo, medtem ko obe kovini izmenjajo elektrone. Zato lahko enačbo zapišemo kot:
2ag+ + Cu => 2ag + cu2+
Upoštevajte, da so tako obremenitve kot atomi uravnoteženi.
To je sestavljeno iz kemičnega zmanjšanja: v dobiček elektronov, ki naredijo oksidacijska stanja atomov, ki jih elektroni zaslužijo manj pozitivno.
Število kisika
Kisik so zelo elektronegativni in oksidirajoči atomi, tako da, ko je atom, sestavljen z njimi (na primer oksidi), imajo pozitivna oksidacijska stanja. Večje kot je število kisika, ki deluje z atomom, bolj pozitivna bo njegova oksidacija. Ali kaj je enako, bolj oksidira.
Torej, ko ima spojina manj kisikovih atomov, se reče, da je manj oksidirana. To pomeni, da atom izgubi manj elektronov.
Klasičen primer je razvidno iz monoksida in ogljikovega dioksida. Za CO ima ogljik stanje oksidacije +2, medtem ko je za CO₂ njen status oksidacije +4.
Torej, če se v reakciji pretvori v CO, se reče, da se dogaja zmanjšanje, saj ogljik zdaj deluje s kisikom in ne z dvema. Za nasprotno reakcijo, ko -transformiranje, govori o oksidaciji ogljika.
Vam lahko služi: železov klorid (FECL2): struktura, uporabe, lastnostiTo velja za vse atome, zlasti kovine v njihovih kovinskih oksidih. Na primer CRO2 (Cr4+) in cro3 (Cr6+).
V kemijskih enačbah, kjer vrsta izgubi kisik, medtem ko ga druga vrsta zasluži, naj bi se pojavil prenos kisika.
Elektronegativni atom
Vedno je mogoče ugotoviti, če je prišlo do zmanjšanja s spremembo statusa oksidacije na manj pozitivno vrednost. Kot ste pravkar pojasnili, je hiter način, da ga opazimo, ne da bi izračunali, opazi, ali se v atomih kisika zmanjša v spojini.
Enako se lahko zgodi pri katerem koli drugem atomu, ki je bolj elektronegativen od atoma, ki zmaga ali izgubi elektrone.
Na primer, če CF4 reagira tako, da postane cho4, Takrat se reče, da je prišlo do zmanjšanja, saj je fluorid veliko bolj elektronegativen kot vodikov atom. Kot rezultat, je ogljik manj oksidiran v CHO4 da v CF4, kar je enako reči, da se je zmanjšalo.
Primeri
Zmanjšanje organske kemije
Primer CF4 in pogl4 odraža, kaj se zgodi v organskih reakcijah, kjer se zmanjšanje delne obremenitve atoma šteje za elektronski dobiček. To velja veliko, če upoštevamo zmanjšanje oksigeniranih funkcionalnih skupin.
Na primer, razmislite o skupinah ROH, RCHO in COOH. Prvi ustreza alkoholom, kjer je ogljik povezan s kisikom (C-OH); Druga je skupina aldehida, kjer ogljik tvori dvojno vez s kisikom in je tudi povezan z vodikom (C = O-H), tretja pa je karboksilna skupina.
Vam lahko služi: Beryl hidroksid (biti (OH) 2)V karboksilni skupini ogljik tvori dvojno vez z O in preprosto povezavo z drugim O (HO-C = O).
Zato pride do zmanjšanja, če se karboksilna kislina spremeni v alkohol:
Rcooh => roh
Ekstrakcija kovine
Kemično zmanjšanje je izredno pomembno pri postopkih ekstrakcije kovin iz njihovih mineralov. Nekatere reakcije so:
HGS + O2 => Hg + tako2
Živosrebrni sulfid se zmanjša na kovinsko živo srebro.
Cu2S + o2 => 2CU + SO2
Bakreni sulfid do kovinskega bakra se zmanjša.
2ZN + 3o2 => 2ZNO + 2SO2
ZnO + C => Zn + Co (opazite prenos o).
Cinkov sulfid se najprej zmanjša na svoj monoksid in nato na kovinsko obliko.
Vera2Tudi3 + 3CO => 2FE + 3CO2
Železni oksid se zmanjša na kovinsko železo.
Wo3 + 3H2 => W + 3H2Tudi
In volframovi trioksid se zmanjša na kovinski volfram.
Kot vajo lahko določite oksidacijsko število kovine, preden se zmanjša.
Drugi primeri
- Železni ion (III) se lahko zmanjša na železo (II):
- Etino se lahko zmanjša na Eteno:
- Etanal lahko zmanjšamo na etanol
Reference
- Oksidacijske reakcije. Kem je okreval.Librettexts.org.
- Opredelitev zmanjšanja kemije. Opomogel od Thoughtco.com.




