Endergonska reakcija

- 911
- 196
- Miguel Gutmann DVM
 Trdna reakcija je ta, da ne -spontana in ki zahteva veliko energije
Trdna reakcija je ta, da ne -spontana in ki zahteva veliko energije Kaj je resnična reakcija?
A Endergonska reakcija To je tisti, ki ni spontan in zahteva tudi visoko oskrbo z energijo. V kemiji je ta energija običajno kalorična. Najbolj znano med vsemi endotermičnimi reakcijami so endotermične reakcije, torej tiste, ki absorbirajo toploto.
Razlog, zakaj ne vse reakcije, so spontani, ker porabijo energijo, sistemi, ki jih tvorijo vpletene vrste, pa zmanjšujejo njihovo entropijo. Z drugimi besedami, za kemične namene postanejo molekularno bolj urejeni.
Gradnja opečne stene je primer resnične reakcije. Opeke niso dovolj kompaktne, da bi tvorilo trdno telo. To je zato, ker ni nobenega povečanja energije, ki bi spodbujal njegovo zvezo (odraža tudi v njegovih možnih nizkih intermolekularnih interakcijah).
Za gradnjo stene potrebujete cement in delovno silo. To je energija in ne -stentana reakcija (stena ne bo samodejno zgrajena) postane mogoča, če zaznamo energijsko korist (ekonomska, v primeru stene).
Če ni koristi, se bo stena zrušila ob kakršni koli motnji in njihove opeke nikoli ne morejo ostati združene. Enako velja za številne kemične spojine, katerih gradbeni bloki se ne morejo spontano pridružiti.
Značilnosti resnične reakcije
- Ni spontano.
- Absorbira toploto (ali druga vrsta energije).
Razlog je v tem, da imajo njihovi izdelki več energije kot reagenti, vključeni v reakcijo. Zgoraj je lahko predstavljeno z naslednjo enačbo:
ΔG = gIzdelki-GReagenti
Kjer je ΔG sprememba proste energije Gibbs. Kot gIzdelek je večji (ker je bolj energičen) kot gReagenti, Odštevanje mora biti večje od nič (ΔG> 0). Naslednja slika povzema novo razloženo:
Vam lahko služi: natrijev sulfat (na2SO4): struktura, lastnosti, uporabe, pridobivanje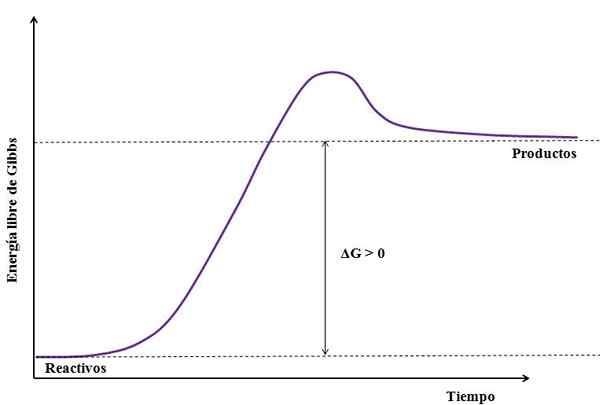 Slika endergonske reakcije. Vir: Gabriel Bolívar
Slika endergonske reakcije. Vir: Gabriel Bolívar Upoštevajte razliko med energijskimi stanji med produkti in reagenti (vijolična linija). Zato se reagenti ne spremenijo v izdelke (A+B => C), če najprej ni absorpcije toplote.
Povečajte brezplačno energijsko energijo
Vsaka endergonska reakcija ima povečanje energije sistema brez sistema. Če se za določeno reakcijo izpolnjuje, da ΔG> 0, potem ne bo spontano in bo potrebno izvesti oskrbo z energijo.
Kako matematično vedeti, ali je reakcija končna ali ne? Uporaba naslednje enačbe:
ΔG = ΔH-TΔS
Kjer je ΔH entalpija reakcije, to je skupna energija, ki se sprosti ali absorbira, je ΔS sprememba entropije in t temperatura. Faktor TΔS je izguba energije, ki se ne izkorišča pri širitvi ali naročanju molekul v fazi (trdna, tekočina ali soda).
Tako je ΔG energija, ki jo sistem lahko uporabi za opravljanje opravila. Ker ima ΔG pozitiven znak za vztrajno reakcijo, je treba za pridobitev produktov uporabiti energijo ali delo (reagenti).
Torej, če poznate vrednosti ΔH (pozitivne, za endotermično reakcijo in negativno za eksotermično reakcijo) in TΔS lahko veste, ali je reakcija končna -gononska.
To pomeni, da je reakcija endotermična, Ne Nujno je endogonično.
Ledena kocka
Na primer, ledena kocka se topi v tekoči vodi, ki absorbira toploto, kar pomaga ločiti molekule; Vendar je postopek spontan in zato ni resnična reakcija.
V primeru, da se led temelji na temperaturi, ki je pod -100 ° C, postane izraz TΔS enačbe proste energije majhen v primerjavi z ΔH (ker se t zmanjšuje.
Vam lahko služi: karboksilna kislinaZ drugimi besedami: led stopite spodaj -100 ° C je končni postopek in ni spontan. Podoben primer je zamrznitev vode okoli 50 ° C, kar se ne zgodi spontano.
Povezave njihovih izdelkov so šibkejše
Druga pomembna značilnost, povezana tudi z ΔG, je energija novih povezav. Povezave oblikovanih izdelkov so šibkejše od povezav z reagenti.
Vendar se zmanjšanje sile povezav kompenzira z masnim dobičkom, kar se odraža v fizikalnih lastnostih.
Tukaj začne primerjava z opečno steno izgubljati pomen. Glede na zgoraj navedeno morajo biti palice v opekah močnejše od tistih med njimi in cementom. Vendar je stena kot celota bolj toga in odporna na večjo maso.
V povezavi je z eksorgonskimi reakcijami
Če končne reakcije niso spontane, kako se odvijajo v naravi? Odgovor je posledica združevanja z drugimi reakcijami, ki so precej spontane (eksonične) in ki nekako spodbujajo njihov razvoj.
Na primer, naslednja kemična enačba predstavlja to točko:
A + B => C (endergonska reakcija)
C + D => E (Exergonic Reakcija)
Prva reakcija ni spontana, zato seveda ne bi mogla zgoditi. Vendar proizvodnja C omogoča, da se pojavi druga reakcija, ki povzroča in.
Dodajanje Gibbs prostih energij za obe reakciji, ΔG1 in ΔG2, Z rezultatom manj kot nič (ΔG<0), entonces el sistema presentará un incremento de la entropía y, por lo tanto, será espontáneo.
Lahko vam služi: hidrorjiČe C ni reagiral z D, ga nikoli ne bi mogel oblikovati, ker ne bi imel nadomestila z energijo (kot primer denarja z opečno steno). Nato se reče, da sta C in D "Jalan" reagirana, celo enkratna reakcija.
Primeri endorgonskih reakcij
Fotosinteza
Rastline uporabljajo sončno energijo za ustvarjanje ogljikovih hidratov in kisika iz ogljikovega dioksida in vode. Co₂ in o2, Majhne molekule z močnimi vezmi, tvori sladkorji, tarčevskih struktur, ki so težje, trdne in se stopijo pri temperaturi okoli 186 ° C.
Upoštevajte, da so povezave C-C, C-H in C-O šibkejše od povezav O = C = O in O = O. In iz sladkorne enote lahko rastlina sintetizira polisaharide, kot je celuloza.
Sinteza biomolekul in makromolekul
Endermanske reakcije so del anaboličnih procesov. Tako kot ogljikovi hidrati, tudi druge biomolekule, kot so beljakovine in lipidi.
Tvorba diamantov in težkih spojin surove nafte
Diamanti zahtevajo ogromne pritiske in temperature, tako da lahko njihove komponente kompaktne v kristalni trdni snovi.
Vendar so nekatere kristalizacije spontane, čeprav prehajajo z zelo počasnimi hitrostmi (spontanost ni povezana s kinetiko reakcije).
Končno samo surova nafta predstavlja produkt endongonskih reakcij, zlasti težkih ogljikovodikov ali makromolekul, imenovanih asfalteni.
Njihove strukture so zelo zapletene, njihova sinteza pa potrebuje veliko časa (milijone let), toplote in bakterijske ukrepe.
Drugi primeri
- Celično dihanje rastlin.
- Transport kisika v krvnem obtoku.
- Difuzija ionov skozi celične membrane.
- Krčenje mišic.
- Sinteza celičnih beljakovin.
Reference
- Endermanske in ekseronske reakcije. Okreval iz Quimitube.com
- Brezplačna energija. Okreval od Es.Khanacademy.org
- Opredelitev endergonske reakcije. Pridobljeno iz biologije.mreža

