Strukturni radio, lastnosti, uporabe, pridobivanje
- 2024
- 140
- Percy Feeney
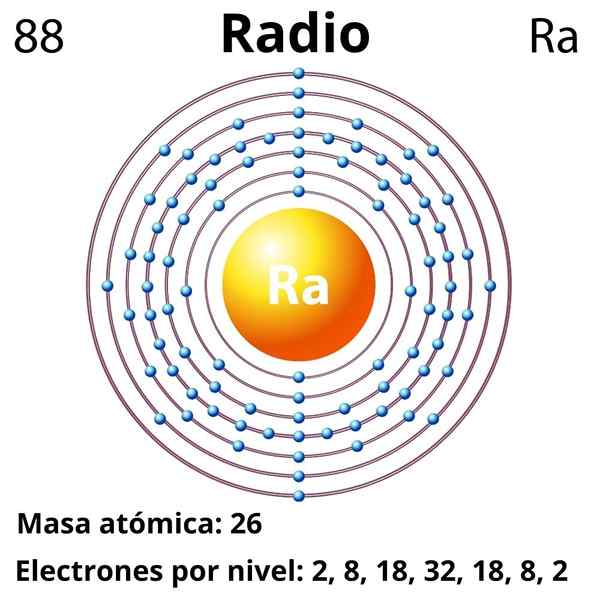
On radio Gre za kovinski element, ki pripada skupini 2 periodične tabele, alkalinoternih kovin, katerih kemični simbol je RA. Je zadnji član te skupine, ki se nahaja pod barijem, in predhodni radioaktivni elementi, kot sta torij in uran; Vendar je polmer približno milijonkrat bolj radioaktiven in zato bolj nevaren od samega urana.
To je element, obkrožen z neverjetnimi in nesrečnimi zgodbami, vse zaradi nepoznavanja njegovih negativnih učinkov na zdravje. Modrost svetlosti njihovih soli in vodnih raztopin sta očarala znanstvenika Pierre in Marie Curie, ki sta jo odkrila v letu 1898, ki sta analizirala nerazložljivo in močno sevanje iz vzorcev pehblede rude, ki jim je njihova vsebnost urana in urana odstranila vsebnost urana in urana in Polonij.
 Ilustracija Marie Curie, odkritka radia
Ilustracija Marie Curie, odkritka radia Odpravljen uran in polonij, Curie in ugotovil, da je v Pechblendi prisoten še en element, odgovoren za močno sevanje, ki ga je domiselno lahko količinsko opredelil. Ta nov element je bil kemično zelo podoben bariju; Vendar pa so bili za razliko od svojih spektralnih zelenih črk iz tega iz karmina.
Tako so po obdelavi, čiščenju in analiziranju ton pechblende dobili 0.1 mg Racl2. Do takrat, leta 1902, so že določili atomsko maso radia, katere ime je izhajalo iz latinske besede "polmer", kar pomeni "Ray". Radio je dobesedno sijoč element.
Osem pozneje, leta 1910, je Marie Curie skupaj s francoskim kemikom Andréjem Louisom Debiernom uspela izolirati polmer v svoji kovinski obliki z elektrolizo Racl2 z uporabo živega srebra. Rodila se je raziskovalna vročina, ki je kasneje postala zaskrbljujoča komercialna, kulturna in zdravilna senzacija.
[TOC]
Struktura
Radio je kovina, katere atomi so zelo zajetni. Posledica tega je, da so njihovi kristali nekaj gosto (čeprav nekoliko več kot iz Bario) in sprejmejo kubično strukturo, osredotočeno na telo (BCC). Iz te strukture se drugim temperaturam ali tlakom ne poročajo nobeni drugi alotrop.
Elektronska konfiguracija

Elektronska konfiguracija za radio je naslednja:
[RN] 7s2
Oksidira z ogromno lahkoto, da postane kation RA2+, ki je izolektronski do plemeniti radonski plin. Zato vse spojine polmera vsebujejo kation ra2+, vzpostavitev pretežno ionskih interakcij; Vendar je ocenjeno, da je mogoče, da lahko zaradi relativističnih učinkov tvori povezave z izjemnim kovalentnim značajem (RA-X).
Vam lahko služi: kalijev benzoat: struktura, lastnosti, pridobivanje, uporabeRadijske lastnosti
 Radijski spojinski vzorec
Radijski spojinski vzorec Fizični videz
Radio je srebrna bela kovina, ki se takoj obarva rumeno in zatemni, ko reagira z dušikom iz zraka, da tvori svoj nitruro, RA3N2. Ker je tako težko manipulirati, je malo fizičnih značilnosti polmera, ki so bile določene neposredno.
Atomska številka
88
Molarna masa
226.03 g/mol
Tališče
Približno 700 ° C. Tega obsega ni bilo mogoče natančno določiti.
Vrelišče
Radio vre med 1100 in 1700 ° C. Ta velika meja netočnosti spet odraža zaplete manipulacije tako nestabilne kovine.
Gostota
5.5 g/cm3
Fuzijska toplota
8.5 kJ/mol
Toplota za uparjanje
113 kJ/mol
Stanje oksidacije
Radio ima eno samo oksidacijsko stanje +2.
Elektronegativnost
0.9. Ta vrednost zvesto ustreza močnemu elektropozitivnemu značaju polmera.
Ionizacijske energije
Prvi: 509.3 kJ/mol
Drugi: 979 kJ/mol
Radioaktivnost
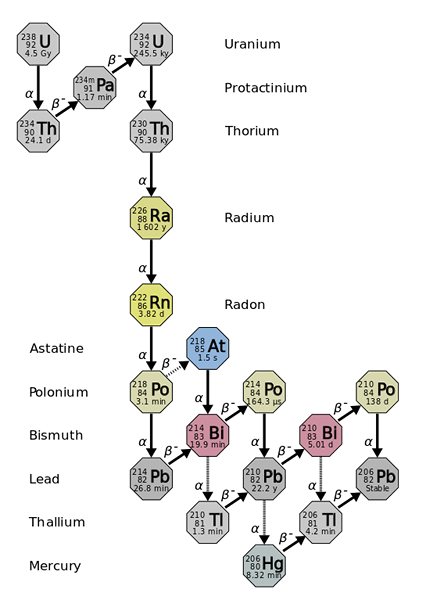 Polmer izhaja iz radioaktivnih upadov težjih in bolj nestabilnih elementov, kot pri izotopu urana-238. Vir: Uporabnik: Tosaka, CC do 3.0, prek Wikimedia Commons
Polmer izhaja iz radioaktivnih upadov težjih in bolj nestabilnih elementov, kot pri izotopu urana-238. Vir: Uporabnik: Tosaka, CC do 3.0, prek Wikimedia Commons Polmer je približno milijonkrat bolj radioaktiven od urana. To je predvsem posledica dejstva, da se iz njega proizvajajo drugi izotopi, na primer 222RN (vrhunska slika), ki posledično razpade tako, da oddaja α delce, da se preoblikujejo v izotop 218Po. Radijski vzorec torej izda velike količine α in β delcev-, kot tudi γ žarki.
Na primer, gram radia, trpi 3.7 · 1010 Razpad na sekundo, ukrep, ki je služil za določitev enote CI, imenovano Curie. Ta energija je dovolj za ogrevanje vzorca 25 gramov vode 1 ° C na uro.
Če opazimo verigo razpada, bo razvidno, da je začetni izotop, 238U, imaš t1/2 od 4.5 giga let (milijarde let); medtem ko namesto tega 226Ra ima a t1/2 1600 let, ki proizvajajo tudi izotope z t1/2 le nekaj dni, minut in sekunde.
Radioaktivnost radia in njegovih spojin je ionizirajoča, zato fluorescentne snovi, tudi okoliške atome, ponoči prižgejo, da lahko sprožijo eksplozivne reakcije. Ta lastnost je znana kot radioluminiscenca.
Spojine in reaktivnost
Ko se soli ali radijske spojine segrejejo v vžigalniku. Takšne trdne snovi so ponavadi bele ali brezbarvne, vendar so barvane rumene in na koncu zatemnijo kot posledica radioaktivnosti radijskih atomov. Če imajo nečistoče na bariju, lahko pokažejo roza tone.
Vam lahko služi: dvojna reakcija nadomestitveRadijska kemija je zelo podobna Bariu, kot da bi bila dva neločljiva brata, Ra-Ba. Obe tvorita iste soli, netopne v vodi, z razliko, da sta polmera nekoliko bolj nerešljiva. Na primer radio sulfat, satin4, Je bolj netopna kot barijev sulfat, baso4; Pravzaprav je najbolj netopen sulfat, kar jih je bilo znano: 2.1 mg tega se raztopi le v 1 liter vode.
Po drugi strani pa radijski hidroksid, RA (OH)2, Je najbolj topna in osnovna od vseh hidroksidov njihovih vrstnikov.
V rešitvi, ramasti2+, Namesto da bi se obnašali kot Lewisove kisline, so osnovne, saj njihove velike velikosti za molekule onemogoča.
Kemična analogija med radiom in barijem se na to kovino težko loči, ker soli soprecipirajo s soli.
Radio uporablja/aplikacije
Svetleče ure
 Svetleče in fosforescentne ure so bile zelo zaželene v devetnajstem stoletju, zaradi njihove vizualne privlačnosti in za vsebovanje priznanega radia na svojih slikah. Vir: orožje95, cc by-sa 3.0, prek Wikimedia Commons
Svetleče in fosforescentne ure so bile zelo zaželene v devetnajstem stoletju, zaradi njihove vizualne privlačnosti in za vsebovanje priznanega radia na svojih slikah. Vir: orožje95, cc by-sa 3.0, prek Wikimedia Commons Najbolj priljubljena in kontroverzna uporaba polmera je bila uporabiti kot dodatek za slike ur. Njeni atomi so bili vključeni v pastomske formulacije cinkovega sulfida, ZNS, ki so absorbirale radioaktivne emisije, da bi sproščale zeleno in fosforescentno svetlobo. Barva je bila nanesena na roke ure (vrhunska slika).
Težava te uporabe je bila v neprekinjeni radioaktivni izpostavljenosti, ki je vplivala na uporabnike teh ur; Ali še huje, delavcem, ki so jih naslikali v tovarnah.
Leta 1924 je več zaposlenih, ki so delale v barvni industriji, pozneje znane kot Radio Girls (Radium Girl Sposoben nanesti radioaktivno barvo na urah.
To se je končalo v pravnem škandalu, ki je spremenil zakone o pri delu, poleg nepoznavanja polmera in majhne etike, da ne uvedejo zaščitnih ukrepov, ki so zagotovili varnost delavcev.
Vam lahko služi: najem halogenuros: nepremičnine, pridobivanje, primeriRadijske slike so nehale izdelovati leta 1960; Čeprav je danes na njihovih površinah več zbirateljskih primerkov.
Radithor
 Steklenica Radithor je bila razstavljena v Nacionalnem muzeju jedrske znanosti in zgodovine v Novi Mehiki. Vir: Sam Larussa iz Združenih držav Amerike, CC BY-SA 2.0, prek Wikimedia Commons
Steklenica Radithor je bila razstavljena v Nacionalnem muzeju jedrske znanosti in zgodovine v Novi Mehiki. Vir: Sam Larussa iz Združenih držav Amerike, CC BY-SA 2.0, prek Wikimedia Commons Radithor je bil eden izmed mnogih farmacevtskih in kozmetičnih izdelkov, ki so razglasili radijsko učinkovitost za boj proti tisoč in enemu bolniku. Vseboval je mikrometrično radijsko količino, ki mora zdraviti vse prebavne in endokrine bolezni. Vendar pa je leta 1932 po smrti Edena Byersa, eden njegovih najbolj gorečih potrošnikov, zapustil trg.
Radioterapija
Niso vse radijske uporabe senzacionalistični, psevdoznanstveni in brezobzirni (ali kriminalci). Za zdravje je bilo res koristno tudi za zdravje. Radijske soli, racl2 in rab2, Uporabljajo se pri zdravljenju raka, zlasti kostnemu raku.
Izotop 223RA, ko jih kalcijevi ioni zmedejo v presnovi, na koncu uniči rakave celice, ki se nahajajo v kosti.
Vendar pa so številne terapevtske uporabe polmera nadomestile varnejši, gospodarski in učinkoviti izotopi, kot so 60Co in 137Cs.
Pridobivanje
Radio je eden izmed elementov, katerih proizvodnje je malo: le približno 100 gramov na leto po vsem svetu. Tone uranove oranžne, kot je pechbleda (ali uraninitna) ruda, se obdelajo po metodi Curie, ki je sestavljena iz zdravljenja vzorcev z natrijevim hidroksidom, klorovodikovo kislino in natrijevim karbonatom, tako da je mešanica radijskih in barijevih sulfatov, satena4-Baso4.
Satenasta mešanica4-Baso4 Preoblikovano je bilo v njihove kloride, Racl2-Bacl2, ločevanje kationov ra2+ z frakcijskimi kristalizacijami in končno čiščenjem ionske kromatografske tehnike. Racl2 Zmanjša se z elektrolizo ali ga zmanjša s kovinskim aluminijem na 1200 ° C.
Izotopi
Vsi radijski izotopi so radioaktivni. Štirje od njih obstajajo v naravi kot izdelki radioaktivnega razpada atomov 232Th, 235U in 238Ali.
Ti štirje izotopi so: 223Ra (t1/2= 11.4 dni), 224Ra (t1/2= 3.64 dni), 226Ra (t1/2= 1600 let) in 228Ra (5.75 let). Očitno je, da skoraj vsi radijski atomi sestavljajo izotopske mešanice 226Ra in 228Ra, ker se drugi hitro razpadajo.
On 226Ra je najbolj stabilen od vseh izotopov radia, vsi drugi pa so preveč nestabilni, z t1/2 Manj kot dve uri.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Radij. Pridobljeno iz: v.Wikipedija.org
- Uredniki Enyclopeedia Britannica. (2020). Radij. Okrevano od: Britannica.com
- Radioaktivnost. (s.F.). Radium: radioaktivno jedro, ki je postalo zgodovino. Okrevano od: radioaktivnosti.EU.com
- Cantrill, v. (2018). Realnosti radija. Nature Chem 10, 898. doi.org/10.1038/S41557-018-0114-8
- Elsevier b.V. (2020). Radij. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- « Dejavniki erozije vetra, vrste, posledice, primeri
- Italični polotok Geografija, države, flora, favna, podnebje »

