Kiralnost
- 3941
- 975
- Mr. Shane Larkin
 Kiralnost je povezana z asimetrijo in se zgodi, ko elementa ni mogoče namestiti v ogledalo v ogledalu. Vir: Gabriel Bolívar
Kiralnost je povezana z asimetrijo in se zgodi, ko elementa ni mogoče namestiti v ogledalo v ogledalu. Vir: Gabriel Bolívar Kaj je kiralnost?
The kiralnost Gre za geometrijsko lastnost, v kateri ima predmet dve sliki: eno desno in eno levo, ki nista zamenljiva. To pomeni, da so prostorsko drugačni, čeprav so ostale njihove lastnosti enake. Predmet, ki ima kiralnost, je preprosto rečeno, da je "kiralno".
Desna in leva roka sta kirala: ena je odsev (spekularna slika) drugega, vendar niso enaki, saj ko se postavijo na drugo, se ne ujemajo s palcem.
Več kot ogledalo, če želite vedeti, ali je predmet kiralen, je treba postaviti naslednje vprašanje: ali imate "različice" tako za levo kot desno stran?
Na primer, doppit za levo in drugi za desno -so kiralni predmeti. Dva vozila istega modela, vendar z volanom na levi ali desni, nekaj čevljev, tako kot stopala. Polževe stopnice v levi smeri in v desni smeri itd.
In v kemiji molekule niso izjema: lahko so tudi kirali. Na zgornji sliki je prikazan par molekul s tetraedrsko geometrijo.
Čeprav je leva obrnjena in sfere modre in vijolične, rjave in zelene barve "izgledajo" iz letala.
Kako določiti molekularno kiralnost?
Z molekulami ni tako enostavno določiti, katera je leva ali desna "različica", ki jih samo gleda.
Za to se organske kemikalije zatečejo k konfiguracijam (R) ali (S) Cahn-Ingold-predlog ali temeljijo na optični lastnosti teh kiralnih snovi za vrtenje polarizirane svetlobe (ki je tudi kiralni element).
Lahko vam služi: litij: zgodovina, struktura, lastnosti, tveganja in uporabeVendar ni težko ugotoviti, ali je molekula ali spojina kiralna samo z opazovanjem njegove strukture. Kakšna presenetljiva posebnost ima navor zgornje slike?
Ima štiri različne substituente, vsaka s svojo značilno barvo, tudi geometrija okoli osrednjega atoma pa je tetraedrska.
Če obstaja atom s štirimi različnimi substituenti v strukturi, je mogoče potrditi (v večini primerov), da je molekula kiralna.
Potem se reče, da je v strukturi središče kiralnosti oz Stereogeni center. Kjer je ena, bo nekaj stereoizomerov, znanih kot enantiomeri.
Dve molekuli slike sta enantiomeri. Večje kot je število kiralnih središč, ki imajo spojino, večja je prostorska raznolikost.
Osrednji atom je običajno ogljikov atom v vseh biomolekulah in spojinah s farmakološko aktivnostjo. Vendar je lahko tudi fosfor, dušik ali kovina.
Primeri kiralnosti
Kiralni center je morda eden najpomembnejših elementov pri določanju, ali je spojina kiralna ali ne.
Vendar pa obstajajo tudi drugi dejavniki, ki lahko ostanejo neopaženi, vendar v 3D modelih prikazuje zrcalno sliko, ki je ni mogoče namestiti.
Za te strukture pravijo, da imajo namesto centra druge elemente kiralnosti.
S tem v mislih prisotnost asimetričnega središča s štirimi substituenti ni več dovolj, tudi preostali del strukture.
Lahko vam služi: cinkov hidroksid (Zn (OH) 2)Osi
 Strukture aleno in bifenilne spojine. Vir: Wikimedia Commons
Strukture aleno in bifenilne spojine. Vir: Wikimedia Commons V zgornji sliki so prikazane spojine, ki se morda zdijo ravne s prostim očesom, vendar res niso.
Na levi strani imate splošno strukturo Aleno, kjer R označuje štiri različne substituente. In na desni, splošna struktura bifenilne spojine.
Konec, kjer najdemo r3 in r4 Lahko bi ga vizualizirali kot "plavut", pravokotno na letalo, kjer lažejo1 in r2.
Če opazovalec analizira takšne molekule, ki postavljajo oko pred prvim ogljikom, povezanim z R1 in r2 (Za aleno) boste videli r1 in r2 na levi in desni strani in na r4 in r3 gor in dol.
DA R3 in r4 Ostajajo fiksni, vendar r1 Desno in r2 Na levi bo nato še ena "vesoljska različica".
Tu lahko opazovalec sklepa, da je našel os kiralnosti za Aleno. Enako velja za bifenil, vendar z aromatičnimi obroči, ki so vključeni v vizijo.
Obroči ali vijaki za helikost
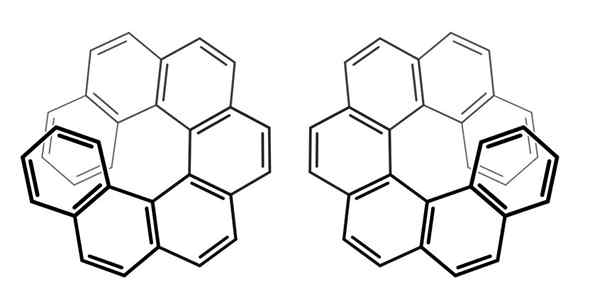
 Os kiralnosti v hepteliicenosu. Vir: Wikimedia Commons
Os kiralnosti v hepteliicenosu. Vir: Wikimedia Commons Upoštevajte, da je v prejšnjem primeru os kiralnosti ležala v okostju C = C = C, za Aleno in v povezavi AR-AR, za bifenil.
Za zgornje spojine, imenovane Hephehelicenos (za sedem obročev), je njegova os kiralnosti osi z, propeler.
Zato morate te molekule opazovati od enega enantimera drugega (po možnosti).
Na ta način je mogoče podrobno opisati, da se hepheliicen vrti v smeri igle ure (leva stran slike) ali v smeri antihorarija (desna stran slike).
Vam lahko služi: natrijev hidroksid (NaOH): struktura, lastnosti, uporabe, sintezaNačrt
Recimo, da ni več helikena, ampak molekula z nekoplanarnimi obroči, torej ena je nad ali pod drugim (ali ni v isti ravnini).
Tu kiralni lik ne počiva toliko v obroču, ampak v njegovih substituentih, saj so ti definirali vsakega od obeh enantiomerov.
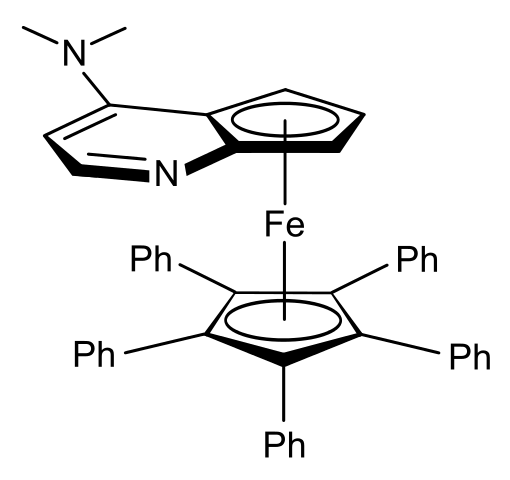
 Planarna kiralnost. Vir: Wikimedia Commons
Planarna kiralnost. Vir: Wikimedia Commons Na primer, v Ferroenu zgornje slike imate, da se obroči, ki "vdelajo" atom vere, ne spreminjajo, ampak prostorska orientacija obroča z atomom dušika in skupino -N3)2.
Na sliki je skupina -n (CHO3)2 kaže levo, v svojem Enantiómero pa bo pokazal na desno.
Drugi
Za makromolekule ali tiste z edinstvenimi strukturami se panorama začne poenostaviti. To je zato, ker lahko iz njegovih 3D modelov vidite ptičji let, če so kirali ali ne, kot pri predmeti začetnih primerov.
Na primer, ogljikova nanocevka lahko pokaže zavoje na levo, zato je kiralno, če obstaja enaka, vendar z zavoji na desno.
Enako velja za druge strukture, kjer lahko prostorsko razpolaganje vseh atomov, čeprav nimajo središč kiralnosti, sprejmejo kiralne oblike.
Nato se govori o prirojeni kiralnosti, ki ni odvisna od atoma, ampak od celotnega niza.
Kemično silna oblika razlikovanja "leve slike" od tiste na desni je skozi stereoselektivno reakcijo, torej tam, kjer lahko prehaja le z enantiomerom, medtem ko z drugim ne.
Reference
- Kiralnost (kemija). Pridobljeno iz.Wikipedija.org
- Chirralnost. Okrevano od kemijske ocene.com

