Obljubljena (PM) struktura, lastnosti, pridobivanje, uporabe

- 3645
- 959
- Lee Farrell
On obljubljeno To je kemični element, ki spada v razred lantanidov. Identificiran je s simbolom PM in njegova atomska številka je 61. To je radioaktivna kovinska trdna snov in je najbolj nestabilen element prvih 84 elementov periodične tabele.
Ta element seveda najdemo v zelo nizkih koncentracijah (približno 4 x 10-petnajst grami na kg) V vrsti uraninita, ki je mineral urana, v katerem je obljubljeno prisoten zaradi spontane cepitve urana-238.
 Simbol, atomsko število in atomska masa obljube. Vir: ME/CC by-S (https: // createCommons.Org/licence/by-sa/2.5). Vir: Wikimedia Commons.
Simbol, atomsko število in atomska masa obljube. Vir: ME/CC by-S (https: // createCommons.Org/licence/by-sa/2.5). Vir: Wikimedia Commons. Kljub pomanjkanju zemeljske skorje je bil odkrit v spektru zvezde HR465 Andromeda Constellation, na čigar površini se ocenjuje, da se je pred kratkim oblikoval, saj noben izotop nima daljše polovice 17, v življenju 17, 7 let.
Bilo je koristno pri predmetih, ki sijejo v temi, vendar je zaradi njihove radioaktivnosti nehala uporabljati pri teh. Uporablja se za merjenje debeline materiala in jedrske energije.
[TOC]
Odkritje
Obstoj Prostetio je leta 1902 sumil kemik češki Bohuslav Brauner. Kasneje, leta 1914, je angleški fizik Henry Moseley v svojih študijah ugotovil, da manjka element med neodimijem in samarijem.
Kasneje, čeprav je več skupin raziskovalcev (Italijanov leta 1924, Američani v letih 1926 in 1938) napovedalo njihovo odkritje, težave pri ločevanju od drugih elementov in reproduciranja izkušenj.
 Jakob a. Marinsky. ORNL / pub domena. Vir: Wikimedia Commons.
Jakob a. Marinsky. ORNL / pub domena. Vir: Wikimedia Commons. Končno, leta 1944 so raziskovalci Marinsky J.Do., Glendenin l.In. in Coryell c.D. Preizkusili so svojo prisotnost in jo izolirali iz produktov cepitve urana v jedrskem reaktorju Clinton Laboratories v Oak Ridgeu v Tennesseeju v ZDA.
 Larry e. Glendenin. ORNL / pub domena. Vir: Wikimedia Commons.
Larry e. Glendenin. ORNL / pub domena. Vir: Wikimedia Commons. Vendar pa niso trdili prednostne naloge na odkritju šele leta 1946, ker so bili v celoti predani tajnim preiskavam, povezanim z obrambnimi dejavnostmi med drugo svetovno vojno.
Naloga imena
Čeprav so ga raziskovalci predlagali, da bi ga poimenovali "Clintonium" v čast laboratorijev, kjer so delali, je Coryellova žena prepričala, naj ga imenujejo "obljubljeni" kot spomin na grškega Titana Prometeja ali Prometeja.
 Charles d. Coryell. Avtor fotografije: Christian a. CORYELL/GFDL (http: // www.GNU.Org/copyleft/fdl.html). Vir: Wikimedia Commons.
Charles d. Coryell. Avtor fotografije: Christian a. CORYELL/GFDL (http: // www.GNU.Org/copyleft/fdl.html). Vir: Wikimedia Commons. Po nekaterih interpretacijah grške mitologije je Prometej ukradel bogove ogenj, da bi ga dal človeštvu, zato je bil kruto kaznovan za vse večnosti. Druge legende pravijo, da je človeku zagotavljal matematiko, znanost, kmetijstvo in medicino ter celo ustvaril človek.
Lahko vam služi: Clausius-Clapeyronova enačba: za kaj je, primeri, vaje Prometeja zastopanost nemškega kiparja. © El Grafo / CC-BY-SA-4.0 / pub domena. Vir: Wikimedia Commons.
Prometeja zastopanost nemškega kiparja. © El Grafo / CC-BY-SA-4.0 / pub domena. Vir: Wikimedia Commons. Ti dvomi o tem, kaj je bil Prometheusov prispevek k človečnosti, spominja na negotovost o tem, kdo je odkril element. Po drugi strani je bilo po Coryellovi ženi ime upravičeno, saj so raziskovalci "ukradli ogenj bogov", ko so ga odkrili med programom tajnega bombe.
Elektronska struktura
Elektronska konfiguracija tega elementa je:
1s2; 2s2 2str6; 3s2 3str6 3d10; 4s2 4str6 4d10; 5s2 5str6; 4F5 6s2;
ki se lahko izraža tudi kot:
[Xe] 4F5 6s2.
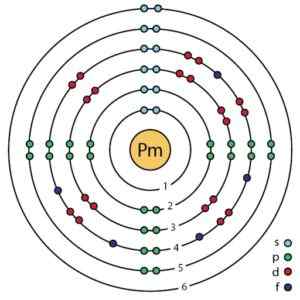 Prostetio Elektronska struktura v skladu z Bohrjevim izboljšanim atomskim modelom. Ahazard.Sciencewriter/CC BY-SA (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons.
Prostetio Elektronska struktura v skladu z Bohrjevim izboljšanim atomskim modelom. Ahazard.Sciencewriter/CC BY-SA (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons. Nomenklatura
- Obljubljen, simbol pm.
- Prostetio-147, PM-147 oz 147PM: Isotope del Prostetio z atomsko maso 147.
Lastnosti Prostetio
Fizično stanje
Čudovini kovinski trdni, šesterokotni kristali.
Atomska masa
144.91
Tališče
1042 ° C
Vrelišče
3000 ° C
Gostota
7.26 g/cm3
Kemične lastnosti
Pripada družini lantanidov, lantanoidov ali "redkih zemlje", imenovani tako, ker so v Zemljini skorji vedno v obliki svojih oksidov. So del 6. obdobja periodične tabele elementov.
Po mnenju virov, ki so se posvetovali, PM, tako kot druge lantanide, reagira neposredno z vodo, počasi hladno, hitro pri segrevanju in sproščanju vodika (h2). Hitro se zatemni v zraku in zgorela, kar zlahka proizvaja svoj oksid.
Pripravljenih je več kot 30 prometio. Njen status oksidacije v teh spojinah je +3. Ne tvori tetravalentnih kationov.
Oblikovanje nekaterih spojin
Raztopi v klorovodikovo kislino (HCl) Obljubljeno tvori PMCL3 ki je rumena in vodna topna. V dušikovi kislini (hno3) PM se ustvari (ne3)3 to je roza in tudi topno v vodi.
Če rešitev, ki vsebuje PM ione3+ je alkaliziran z NH3, To pomeni, da se pH poveča, obori hidroksida (PM (OH)3) svetlo rjava.
Vam lahko služi: ionska povezava: značilnosti, kako se oblikuje, in primeriPm sulfat2(SW4)3 V vodi je rahlo topen. Če je Oxalat Prostetio segret, postane PM oksid2Tudi3 bela ali sivka.
Radioaktivna emisija
Oddaja beta sevanje v obliki elektronov, ki zapuščajo jedro svojih atomov. Ko ga izdajate, postane element Samarium (SM). Po drugi strani pa lahko postane neodimij (ND) z odpravo jednega pozitrona in zajemanja elektrona v istem. PM ne oddaja gama žarkov.
Izotopi
Do zdaj je znanih 14 izotopov Prostetio z atomskimi masami, ki segajo od 134 do 155. Vsi so nestabilni (radioaktivni), kar jo razlikuje od drugih lantanidov.
Prostetio-147 je tisti z največjo uporabnostjo in ima razpolovno dobo 2,6 leta.
Izotop z večjo polovico življenja
Najdaljši izotop Half-Life je Prostetio-145 s 17,7 leti, kar razpade z elektronskim zajemanjem, ki ga sestavlja atomski elektron, je kombiniran s protonom in tvori nevtron in nevtrino.
Vendar je edini izotop PM, ki lahko tudi utrpi alfa razpad (emisija 2 nevtronov). To je zato, ker ima 84 nevtronov in izdajo dveh od njih naredi Prostetio-141 z 82 nevtroni, kar je stabilna konfiguracija jedra. Toda to je vrsta razpada, ki se pojavi zelo malo.
Tok pridobivanje
Leta 1963 smo pripravili približno 10 gramov prostetio z metodami ionske izmenjave kromatografije v odpadkih z atomskimi reaktorji. Danes se na ta način še vedno okreva kot soli 147P.m3+.
Po določenih virih je bil v teh letih pripravljen tudi z zmanjšanjem fluorida (PMF3) Z litijevo paro (li). Pripravimo ga tudi z zmanjšanjem klorida (PMCL3) S kalcijam (CA) pri visokih temperaturah.
Dobimo ga lahko tudi iz neodimija-146. Ta izotop je podvržen bombardiranju z nevtroni, tako da vsak atom zajame nevtron in postane neodimij-147. Slednji traja približno 11 dni, ki trpijo beta razpadanje, s čimer se preoblikuje v prostetio-147.
Prijave
Izotop 147 (147PM) je tisti, ki je bil najbolj uporabljen, edini, ki ga je mogoče najti komercialno. Ne oddaja gama žarkov in je dobavljen v obliki oksida ali klorida. Vendar njihov prevoz in manipulacija zahtevata zaščito pred sevanjem.
Lahko vam služi: hidroliza: kaj je to in primeri reakcijJe imela nekatere uporabe, ki jih danes ni več, ker se trenutno uporablja v posebnih aplikacijah.
V baterijah
Prostetio-147 se uporablja v dolgoročnih atomskih baterijah. V tem primeru so majhni kosi PM postavljeni v matrico polprevodnika za pretvorbo beta emisij v elektriko.
Ta vrsta baterij jedrske energije lahko zagotavljajo energijo približno 5 let in se uporabljajo v vseh vrstah naprav, od raket do spodbujevalnikov, ki so naprave, nameščene pri bolnikih s težavami s srcem.
 Napačni spodbujevalniki imajo lahko dolgoletne baterije, ki temeljijo na Prometio. Avtor: 242799. Vir: Pixabay.
Napačni spodbujevalniki imajo lahko dolgoletne baterije, ki temeljijo na Prometio. Avtor: 242799. Vir: Pixabay. V medicinskih aplikacijah
Po določenih virih se Prostetiov oksid uporablja v medicini kot vir sevanja.
V industriji
Uporablja se za merjenje debeline nekaterih materialov, ki se izvaja z merjenjem beta sevanja, ki poteka skozi vzorce.
Potencialne aplikacije
Lahko bi ga uporabili kot prevozni vir rentgenske reprezentance, a očitno ta aplikacija še ni bila komercialno razvita.
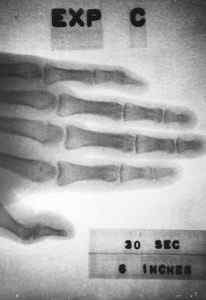 Rentgenska slika, pridobljena leta 1963 z majhno napravo (približno 10 cm x 5 cm x 1 cm), ki vsebuje Prostetio-147. Energija.Domena Gov / Pub. Vir: Wikimedia Commons.
Rentgenska slika, pridobljena leta 1963 z majhno napravo (približno 10 cm x 5 cm x 1 cm), ki vsebuje Prostetio-147. Energija.Domena Gov / Pub. Vir: Wikimedia Commons. Prav tako bi služil zagotavljanju energije za vesoljske in satelitske sonde ali za izdelavo naprav, ki omogočajo komunikacijo s podmornimi.
Ukinjena uporaba v svetlobnih signalih
Sprva je bil Prostetio-147 uporabljen za zamenjavo radijskega elementa v svetlečih številčnicah, saj je bilo izvedeno, da je radio preveč nevaren. Za to je bil PMCL mešan3 Z luminofori, ki sijejo od zelenkasto rumene do modre, ko sevanje obljubljenih (beta delcev) vpliva.
 Pred nekaj deset let je bilo v temi mogoče videti igle zapestnic zaradi svetlosti, ki jo je povzročila radioaktivnost Prometio. Avtor: Monacocannes. Vir: Pixabay.
Pred nekaj deset let je bilo v temi mogoče videti igle zapestnic zaradi svetlosti, ki jo je povzročila radioaktivnost Prometio. Avtor: Monacocannes. Vir: Pixabay. Ta lastnost je bila uporabljena v zapestnicah ali klicah, da bi sijala v temi. Tudi v gumbu za vžig nekaterih fluorescentnih svetilk. Poleg tega ni poškodoval luminoforov, kot je to primer z drugimi viri beta sevanja, kar je podaljšalo življenjsko dobo naprav.
Ko pa je bilo ugotovljeno, da je tudi obetavno nevarno, njegova uporaba na trgu predmetov, ki sijejo v temi.
Tveganja
PM je radioaktivni element, zato ga je treba manipulirati z izjemno previdno in z ustrezno zaščito. Poleg beta delcev, ki oddaja.
 Vzorce Prostetio je treba prevažati znotraj debelega svinčevega ščita, da se izognemo škodljivim učinkom sevanja, ki ga oddajajo. Energija.Domena Gov / Pub. Vir: Wikimedia Commons.
Vzorce Prostetio je treba prevažati znotraj debelega svinčevega ščita, da se izognemo škodljivim učinkom sevanja, ki ga oddajajo. Energija.Domena Gov / Pub. Vir: Wikimedia Commons. Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Promethium - PM (element). Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Ganjali, m.R. et al. (2016). Uvod v serijo Lantanide (od Lanthanuma do Lotetija). Promethium. V seriji Lanthanides Določitev z različnimi analitičnimi metodami. Okrevano od Scientirect.com.
- Choppin, g. et al. (2013). Izvor vesolja in nukleosinteza. Počasen zajem nevtronov. V radiokemiji in jedrski kemiji (četrta izdaja). Okrevano od Scientirect.com.
- Svinec, d.R. (Urednik) (2003). Priročnik za kemijo in fiziko CRC. 85th CRC Press.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Royal Society of Chemistry. (2020). Promethium. RSC je bil obnovljen.org.

