Oxácido
- 819
- 0
- Barry Ernser
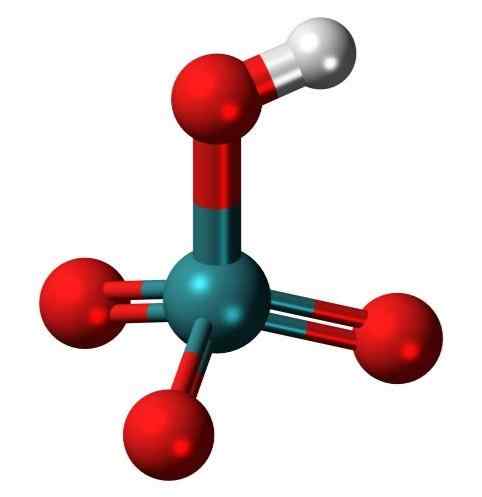
 Molekula pertektetne kisline, zelo redka okso kislina iz Tecnecio. Vir: Jynto, Wikimedia Commons
Molekula pertektetne kisline, zelo redka okso kislina iz Tecnecio. Vir: Jynto, Wikimedia Commons Kaj je oksacid?
A Oxácido, U oksocid, je kislina, ki vsebuje kisik. Sestavljen je iz vodika, kisika in ne -metalnega elementa, ki predstavlja tako usmerjen centralni atom. Odvisno od števila kisikovih atomov in zato lahko oksidacijska stanja ne -metalnega elementa tvorijo več oksicidov.
Oxcacidi imajo veliko število uporab, ki jih je težko opisati na splošno. Njegova uporaba bo močno odvisna od osrednjega atoma in števila kisika.
Lahko služijo iz spojin za sintezo materialov, gnojil in eksploziva, tudi za analitične namene ali proizvodnjo brezalkoholnih pijač, kot se pojavlja z ogljikovo kislino in fosforno kislino, H3Po4, biti del sestave teh pijač.
Značilnosti in lastnosti Oxcacida
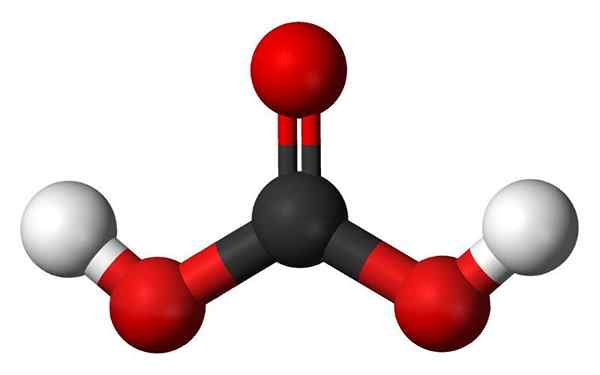 Molekula karbonske kisline. Vir: Jynto in Ben Mills, Wikimedia Commons
Molekula karbonske kisline. Vir: Jynto in Ben Mills, Wikimedia Commons - Hidroksilne skupine: Ena glavnih značilnosti Oxácida ni samo v tem, da ima kisik, ampak tudi to je kot skupina OH. Po drugi strani imajo nekateri oksacidi tisto, kar se imenuje skupina OXO, E = O. V primeru fosforne kisline ima skupino OXO, p = o. Nimajo atomov H, zato "niso odgovorni" za kislost.
- Osrednji atom: Osrednji atom (E) je lahko ali ne bo elektronegativni element, odvisno od njegove lokacije v bloku P periodične tabele. Po drugi strani kisik, nekoliko bolj elektronegativni element kot dušik, pritegne elektrone OH vezi in tako omogoča sproščanje iona H+. E je torej povezan s skupinami OH. Ko je ion H sproščen+ Pojavi se kislinska ionizacija, torej pridobi električni naboj, kar je v njegovem primeru negativno. Oxcacid lahko sprosti toliko H ionov+ Ker imajo skupine OH v svoji strukturi in bolj ko jih je, večja bo negativna obremenitev.
- Kisla sila: Sila skoraj vseh oksicidov, ki imajo enak centralni atom (brez kovine), se poveča s povečanjem stanja oksidacije osrednjega elementa, kar je neposredno povezano s povečanjem števila atomov kisika.
Na primer, prikazane so tri serije Oxacid, katerih kislostne sile so urejene od najmanj do največjega:
H2SW3 < H2SW4
Hno2 < HNO3
Hclo < HClO2 < HClO3 < HClO4
V večini oksicidov, ki imajo različne elemente z istim stanjem oksidacije, vendar pripada isti skupini periodične tabele, se sila kislosti neposredno povečuje z elektronegativnostjo osrednjega atoma:
H2SEO3 < H2SW3
H3Po4 < HNO3
Hbro4 < HClO4
Trgovanje z oksacidi
Kot je bilo omenjeno na začetku, se Oxácidos nastajajo, ko nekatere snovi, imenovane kisli oksidi, reagirajo z vodo. To bo razloženo z istim primerom ogljikove kisline.
Co₂+h₂o h2Co3
Kisli oksid + voda => oxácido
Kar se zgodi, je, da se molekula H₂o kovalentno veže z možem Co₂. Če se voda odpravi s toploto, bo ravnotežje na regeneracijo premikov, to je vroča pijača za sodo.
Po drugi strani se kisli oksidi tvorijo, ko nemetalni element reagira z vodo, čeprav natančneje, ko reakcijski element tvori oksid s kovalentnim znakom, katerega raztopina v vodi ustvarja Hones H ione+.
Že je rečeno, da ioni h+ So produkt nastale ionizacije oksicida.
Primeri usposabljanja
Klorični oksid, Cl2Tudi5, Reagirati z vodo, da daste klorinsko kislino:
Cl2Tudi5 + H₂o => hclo3
Žveplov oksid, torej3, Reagira z vodo, da tvori žveplovo kislino:
SW3 + H₂o => h2SW4
In periódični oksid, i2Tudi7, reagira z vodo, da tvori periódinsko kislino:
Yo2Tudi7 + H₂o => hio4
Poleg teh klasičnih mehanizmov za tvorbo oksicidov obstajajo tudi druge reakcije za isti namen.
Vam lahko služi: endotermična reakcijaNa primer, fosfor triklorid, pcl3, Reagira z vodo, da proizvaja fosforno kislino, oxácido in klorovodikovo kislino, halohidrično kislino.
Pcl3 + 3H2O => h3Po3 + Hcl
In fosfor pentaklorid, pcl5, reagira z vodo, da daje fosforno in klorovodikovo kislino.
Pcl5 + 4 H₂o => H3Po4 + Hcl
Kovinski okkacidi
Nekatere prehodne kovine tvorijo kisline okside, to je, da se raztopijo v vodi, da dajo oksacide.
Manganski oksid (vii) (permanganski anhid) Mn2Tudi7 In najpogostejši primeri kromovega oksida (VI).
Mn2Tudi7 + H₂o => hmno4 (permanganska kislina)
Cro3 + H₂o => h2Cro4 (kromova kislina)
Nomenklatura
Izračun Valencije
Pravilno imenovati oxácid. Začenši iz heo generične formule, upošteva se naslednje:
- O ima Valencia -2.
- Valencia de los h es +1.
Glede na to, Oxácid. Tako imate naslednjo algebrsko vsoto:
-2 + 1 + e = 0
E = 1
Zato je E +1 Valencia.
Potem možne valence, ki lahko imajo in. Če so med njihovimi valencami vrednosti +1, +3 in +4, nato pa "delo" z manjšo Valencijo.
Ime kislina
Če želite imenovati Heo, se začne tako, da ga imenuje Acid, nato pa ime E s priponki -ico, če sodelujete z največjo Valencijo ali -Ono, če sodelujete z mladoletnikom. Ko jih je tri ali več, se hipoponi uporabljajo za sklicevanje na mladoletnika in večjimi valenci.
Tako bi poklicali Heo:
Kislina kolcanje(Ime e)medved
Ker je +1 najmanjši od svojih treh valenc. In če bi bil heo2, Potem bi imel Valencia +3 in bi se imenoval:
Lahko vam postreže: difenilaminKislina (e)medved
In na enak način za heo3, Z E Delo z Valencijo +5:
Kislina (e)ICO
Primeri
- Kromna kislina (h2Cr2Tudi4). Je močna, nestabilna kislina pri visokih temperaturah.
- Dikromna kislina (h2Cr2Tudi7). Njegova prisotnost je opazna v mešanicah kromične kisline, ki se uporabljajo za čiščenje stekla.
- Hipoklorna kislina (HClo). Hitro popravite kožna tkiva.
- Bromozna kislina (hbro2). Je vmesna, nestabilna spojina. BROMO spojina.
- Ortofosforna kislina (h3Po4). Dražilna kislina za kožo, ki ne.
- Permanganska kislina (hmno4). Zelo močna kislina.
- Periódinska kislina (HIO4). Pri organski kemiji se uporablja za analizo struktur drugih molekul.
- Bromska kislina (Hbro3). Oxcacid iz broma. Njegove soli močno oksidirajo.
- Hipobromna kislina (hbro). Uporablja se v razredčeni vodni raztopini in dobimo z reakcijo med vodo in BR2.
- Metafosforna kislina (HPO3). Zelo jedko, brezbarvno in stranišče trdno pri sobni temperaturi.
- Yodijeva kislina (HIO3). Reaktiva, ki se uporablja za odkrivanje morfija v izdelku.
- Žveplova kislina (h2SW3). Povzroča kisli dež.
- Žveplova kislina (h2SW4). Redna za predelavo kovin in gnojila je ena najbolj uporabljenih kemičnih spojin.
- Dušikova kislina (hno3). Laboratorijski reagent, zelo nevaren, ker lahko kuri kožo.
- Klorova kislina (hclo3). Pri razpadu proizvede veliko izdelkov. Hladno je stabilno do 30 -odstotne koncentracije.
- Arsenioso kislina (h3ASO3). Vsebuje arzen in je zelo strupen in rakotvoren. Uporablja se v herbicidih in pesticidih.
- Ortosilična kislina (h4Sio4). Šibka kislina, ki se uporablja kot sredstvo za podporo ali sušilnico.
- Ogljikova kislina (h2Co3). Uporablja se za izdelavo brezalkoholnih pijač.
- Dušikova kislina (hno2). V raztopini je izjemno disociiran.
- Metaborenska kislina (HBO2). Rahlo topna kristalno bela trdna trdna trdna trdna.
Reference
- Običajne oksocidne spojine. Opomogel od Thoughtco.com.

