Lastnosti, konstrukcija, uporaba, tveganja kalcijevega oksalata (CAC2O4)
- 3905
- 846
- Raymond Moen
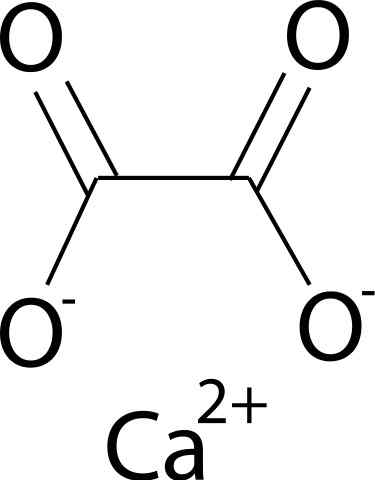
On Kalcijev oksalat Gre za organsko spojino, ki jo tvorijo elementi ogljika (C), kisika (O) in kalcija (CA) (CA) (CA). Njegova kemična formula je CAC2Tudi4. Na splošno ga najdemo v svojih treh hidriranih oblikah: mono-, di- in trihidrat. To je z eno, dvema ali tremi molekulami vode v svoji kristalni strukturi.
Kalcijev oksalat najdemo v mineralih, rastlinah, glivah in drugih živih bitjih, kot so sesalci in celo pri ljudeh kot posledica presnove nekaterih beljakovin. Najdemo ga v urinu ljudi in nekaterih živali.
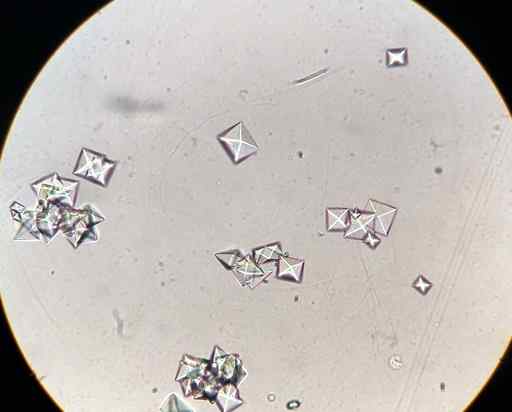 CAC kristali kalcijevega oksalata2Tudi4 V vzorcu urina, opaženega z mikroskopom. J3D3/CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons.
CAC kristali kalcijevega oksalata2Tudi4 V vzorcu urina, opaženega z mikroskopom. J3D3/CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons. Nekaj živil, kot so špinača, ruibarbos, soja.
Se lahko izognete videzu Cac kamnov2Tudi4 V ledvicah, če se zaužijejo veliko tekočin, zlasti z vodo, se izogibajte živila z visoko vsebnostjo oksalata in uživajo tiste, bogate s kalcijam in magnezijem.
Kalcijev oksalat oblikuje neželene vložke v cevi in rezervoarjih, kot so proizvodnja celuloze in papirja, pa tudi v tovarnah piva.
[TOC]
Struktura
Kalcijev oksalat tvori kalcije2+ in oksalatni ion c2Tudi42-. Oksalatni anion je sestavljen iz dveh ogljikovih atomov in štirih kisikovih atomov. Negativne obremenitve oksalatnega aniona najdemo v atomih kisika.
 Kemična struktura kalcijevega oksalata. Vsimonian/cc by-sa (https: // creativeCommons.Org/licence/by-sa/2.5). Vir: Wikimedia Commons.
Kemična struktura kalcijevega oksalata. Vsimonian/cc by-sa (https: // creativeCommons.Org/licence/by-sa/2.5). Vir: Wikimedia Commons. Nomenklatura
- Kalcijev oksalat
- Kalcijeva sol oksalne kisline
- Kalcijeva sol etanodionske kisline
Lastnosti
Fizično stanje
Brezbarvni kristalni, beli, rumeni ali rjavi, ki so lahko v treh različnih hidriranih oblikah.
Molekularna teža
128,1 g/mol
Tališče
Monohidrat kalcijevega oksalata se razgradi na 200 ° C.
Specifična teža
CAC monohidrat2Tudi4 •H2O = 2,22 g/cm3
CAC dihidrat2Tudi4 •2H2O = 1,94 g/cm3
CAC trihidrat2Tudi4 •3H2O = 1,87 g/cm3
Topnost
Skoraj netopna v vodi: 0,00061 g/100 g vode pri 20 ° C. Monohidrat se raztopi v razredčeni kislini.
ph
Vodne raztopine kalcijevega oksalata so šibko osnovne.
Kemične lastnosti
Kalcijev oksalat je kalcijeva sol oksalne kisline. To je naravno sekundarni produkt metabolizma, zato je v človeškem telesu zelo bogat in je del številnih živil.
Oksalna kislina in njegova konjugirana baza, Oxalat, so zelo oksidirane organske spojine, z močno kelacijsko aktivnostjo, to je, da jih je mogoče enostavno kombinirati s pozitivnimi ioni z +2 ali +3 obremenitvami.
Vam lahko služi: Metil ali Metilo GroupNjegove vodne raztopine so šibko osnovne, ker oksalatni ion ponavadi jemlje protone h+ vode, ki sprošča OH ione-. Po odvzemu dveh protonov h+ Oksalatni ion postane oksalna kislina h2C2Tudi4:
C2Tudi42- + H2O → hc2Tudi4- + Oh-
Hc2Tudi4- + H2O → h2C2Tudi4 + Oh-
Prisotnost v naravi
V mineralih
Kalcijev oksalat je najpogostejši oksalat in je predstavljen v obliki mineralov, imenovanih Whewellita, Weddella in Caoxit.
Whewellita je CAC monohidrat2Tudi4 •H2Ali in je najbolj stabilna od oblik te spojine.
 Mineral Rock Whewellita. Rob Lavinsky, Irocks.com-cc-by-sa-3.0/cc BY-SA (https: // creativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons.
Mineral Rock Whewellita. Rob Lavinsky, Irocks.com-cc-by-sa-3.0/cc BY-SA (https: // creativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons. Weddellita je CAC dihidrat2Tudi4 •2H2O in je manj stabilen kot monohidrat.
 Weddelitski mineralni kristali. Leon Hupperichs/cc by (https: // creativeCommons.Org/licence/by/3.0. Vir: Wikimedia Commons.
Weddelitski mineralni kristali. Leon Hupperichs/cc by (https: // creativeCommons.Org/licence/by/3.0. Vir: Wikimedia Commons. Caxita je kalcijev oksalat Trihidrado CAC2Tudi4 •3H2Tudi.
V rastlinah in glivah
Kalcijev oksalat je povezan s suhimi tlemi in listi, tudi s patogeni, prostimi, simbiozi ali rastlinami, povezanimi z rastlinami. V slednjem kristali tvorijo padavine kalcija v obliki njegovega oksalata.
Oblikovanje CAC2Tudi4 Za glive pomembno vpliva na biološke in geokemične procese tal, saj predstavlja rezervo kalcija za ekosistem.
Prisotnost v človeškem telesu in pri sesalcih
Oksalat izvira iz jeter, v rdečih ali eritrocitnih krvnih celicah in v manjši količini v ledvicah. Nastaja iz presnove aminokislin (na primer fenilalanin in triptofana) in z oksidacijo glioksalnega klicanja,.
Vitamin C lahko postane tudi oksalat pri izvajanju svoje antioksidativne funkcije.
Kalcijev oksalat najdemo v kamnih, ki nastanejo v ledvicah ljudi ali živali z ledvičnimi boleznimi.
Tako imenovani izračuni kalcijevega oksalata ali kamnov tvorijo kristalizacijo ali združevanje CAC2Tudi4 V celotnem urinu s kalcijam in oksalatom. To pomeni, da urin vsebuje tako kalcij in oksalat, da ni mogoče, da omenjena spojina ostane raztopljena, vendar se obori ali prehaja v trdno stanje v obliki kristalov.
Pri ljudeh
Oblikovanje peska ali kamnov v ledvicah je bolezen, imenovana nefrolitiaza; Napada približno 10% populacije, približno 75% teh kamnov pa je sestavljen iz CAC kalcijevega oksalata2Tudi4.
 Kalcijev oksalat lahko v ledvicah tvori kamne. Avtor: vsrao. Vir: Pixabay.
Kalcijev oksalat lahko v ledvicah tvori kamne. Avtor: vsrao. Vir: Pixabay. Nastajanje in rast kristalov kalcijevega oksalata v ledvicah se pojavi, ker je pri nekaterih ljudeh urin prenasičen z omenjeno soljo. Kalcijev oksalat se razvije v kislem urinu v pH manj kot 6,0.
Vam lahko služi: isóbarosResiaturacija se pojavi, ko se izločanje ali izločanje te soli (ki je zelo malo topna v vodi) skozi urin v majhni volumen vode.
Dejavniki, ki vplivajo na videz ledvičnih kamnov
Med dejavniki, ki dajejo prednost tvorbi peščenega kalcijevega oksalata, so presežek kalcija v urinu ali hiperkalciuriji, presežek oksalata v urinu ali hiperoksaluriji, elementi, ki izhajajo iz hranjenja, in odsotnost zaviralcev.
Presežek oksalata se lahko med drugimi živimi zaužije velike količine špinače, grobe, soje, oreščkov in čokolade.
 Čokolada je lahko vir kalcijevega oksalata in daje prednost videzu kamnov v ledvicah. Avtor: Aleksander Stein. Vir: Pixabay.
Čokolada je lahko vir kalcijevega oksalata in daje prednost videzu kamnov v ledvicah. Avtor: Aleksander Stein. Vir: Pixabay. Vendar obstajajo snovi, ki zavirajo ali preprečujejo nastanek kamnov. Med spojinami, ki se izogibajo izračunom, so majhne molekule, kot sta citrat in pirofosfat, in velike molekule, kot so glikoproteini in proteoglikani.
Načini, da se izognete tvorbi kamnov kalcijevega oksalata
Dobra strategija za preprečevanje ponovitve peska ali izračunov kalcijevega oksalata, vključno s povečanjem zaužitja tekočine, povečanjem hrane, bogate s kalcijam (na primer mlečni proizvodi) in omejenimi namiznimi soli (NACL), živalskimi beljakovinami, živalskimi beljakovinami in bogatimi obroki v Oxalatu.
Pri živalih
Od začetka leta 2000. Zdi se, da je to odvisno od vrste hrane, ki jo te živali zaužijejo in ima opravka s kislostjo pomanjkanja urina in magnezija (MG).
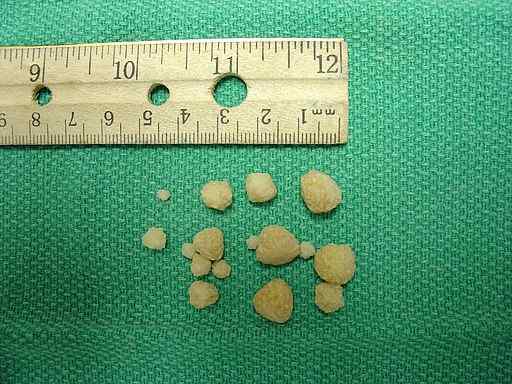 Kalcijevi oksalatni kamni, ki jih najdemo v sečnem mehurju psa. Joel Mills/CC BY-SA (http: // createCommons.Org/licence/by-sa/3.0/). Vir: Wikimedia Commons.
Kalcijevi oksalatni kamni, ki jih najdemo v sečnem mehurju psa. Joel Mills/CC BY-SA (http: // createCommons.Org/licence/by-sa/3.0/). Vir: Wikimedia Commons. Odziv telesa na presežek oksalata
Obstajajo dokazi, da se tako ljudje kot živali odzivajo na presežek oksalata s povečanjem števila bakterij, ki lahko razgradijo oksalat.
Nekatere od teh bakterij so Oxalobacter formate, Bifidobacterium sp., Porphyromonas gingivalis in Bacillus sp., med drugim in so naravno prisotni v črevesju.
Prijave
Po posvetovalnih virih se kalcijev oksalat uporablja v keramični premazi.
Uporablja se za pokrivanje skulptur in drugih umetniških elementov apnenca in ugotovljeno je bilo, da izboljšuje trdoto materiala, zmanjšuje njegovo poroznost in poveča njegovo odpornost na kisline in alkalije.
 V Italiji je doživela pokrivanje predmetov apnenca muzejev s kalcijevim oksalatom, da bi jih ohranil. Avtor: Vir: Moni Quayle. Pixabay.
V Italiji je doživela pokrivanje predmetov apnenca muzejev s kalcijevim oksalatom, da bi jih ohranil. Avtor: Vir: Moni Quayle. Pixabay. Težave v nekaterih procesih
V kalp in papirju lahko kalcijev oksalat tvori vložke, ki povzročajo številne težave v procesu.
Da se izognete njenemu nastajanju v industrijskih procesnih kanalih ali ceveh.
Lahko vam služi: kobalt klorid (COCL2 (: struktura, nomenklatura, lastnostiPrav tako se nabira kot kamen v zabojnikih, kjer se izdeluje pivo, kjer ga je treba izločiti, da se izognete nastajanju mikroorganizmov, ki lahko dajo neprijeten okus pitju.
Tveganja
V visokih koncentracijah lahko oksalat povzroči smrt pri živalih in občasno pri ljudeh zaradi svojih jedkih učinkov.
Nabiranje oksalata in njegove konjugirane kisline, oksalna kislina, lahko povzroči motnje, kot so okvara srca, kamni kalcijevega oksalata, odpoved ledvic in celo smrt zaradi toksičnosti.
Reference
- Glasauer, s.M. et al. (2013). Kovine in metaloidi, transformacija z mikroorganizmi. Oksalati. V referenčni modulaciji v zemeljskih sistemih in okoljskih znanostih. Okrevano od Scientirect.com.
- Baumann, J. M. in Casella, r. (2019). Preprečevanje kalcijeve nefrolitiaze: Vpliv diureze na kristalizacijo kalcijevega oksalata v urinu. Adv Previum, 2019; 2019: 3234867. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Breshears, m.Do. in podelite, da.W. (2017). Urinski sistem. Kalcijevi oksalatni kalkuli. Na patološki osnovi veterinarskih bolezni (šesta izdaja). Okrevano od Scientirect.com.
- Huang in. er al. (2019). TGE ravnanje z oksalatom v telesu TGE in TGE izvor oksalata v kalcijevih oksalatnih kamnih. Urol Int, 2019 5. december: 1-10. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Nilvebrant, n.-Tudi. et al. (2002). Biotehnologija v industriji celuloze in papirja. V teku v biotehnologiji. Okrevano od Scientirect.com.
- Pahira, J.J. In pevzner, m. (2007). Nefrolitiaza. Kalcijevi kamni. V Penn Clinical Priročnik urologije. Okrevano od Scientirect.com.
- Worcester, npr. M. (1994). Zaviralci rasti kristala kalcijevega oksalata v urinu. J Am Soc Nephrol 1994 Nov; 5 (5 Suppl 1): S46-53). Okreval od Jasna.Asnjournals.org.
- Finkielstein, v.Do. in Goldfarb, D.S. (2006). Strategije za preprečevanje kamnov kalcijevega oksalata. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Ali.S. Nacionalna knjižnica medicine. (2019). Kalcijev oksalat. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Peck, a.B. et al. (2015). Mikroorganizmi, ki razgrajujejo oksalat ali encimi, ki razgrajujejo oksalat: ki je prihodnja terapija za encimsko raztapljanje urolitov kalcijevega-oksalata pri ponavljajoči se kamniti bolezni? Urolitiasis, 2016 Feb; 44 (1): 27–32. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Holames, r.Str. et al. (2016). Znižanje izločanja urinskega oksalata za odločitev kalcijevega oksalata kamna. Urolitiaza. 2016 februar; 44 (1); 27-32. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Cyzar, t.M. (1998). Kalcijev oksalat: površinska obdelava apnenca. Journal of Conservation and Museum Studies 4, pp.6-10. Pridobljeno iz JCMS-Journal.com.
- Wikimedia (2019). Kalcijev oksalat. Pridobljeno iz.Wikipedija.org.
- « Kvalitativne raziskovalne značilnosti, vrste, tehnike, primeri
- Funkcionalizem (psihologija) izvor, značilnosti in predstavniki avtorjev »

