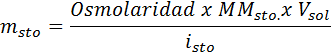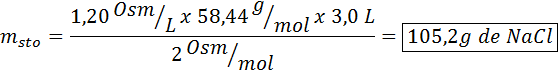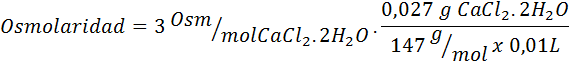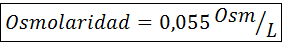Osmolarnost
- 4191
- 1260
- Cary Goyette
Kaj je osmolarnost?
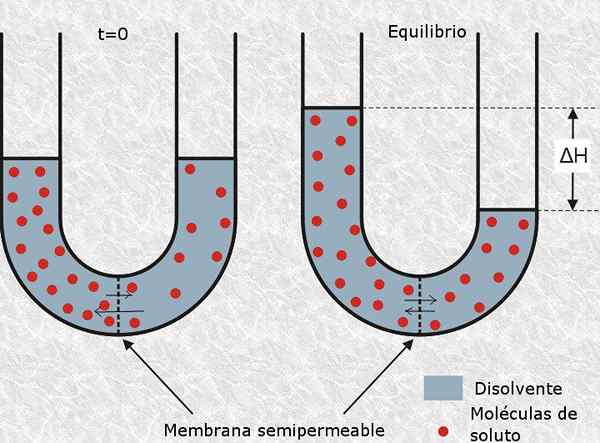
The Osmolarnost To je koncentracijska enota, ki označuje molsko koncentracijo nabora osmotično aktivnih delcev, ki so prisotni v raztopini. Z drugimi besedami, osmolarnost je molarnost osmotično aktivnih delcev.
je opredeljen kot Osmotično aktivni delček na tisto nevtralno ali ionsko molekulo, ki ne more prečkati polprevodne membrane, kot je celična membrana. Prisotnost te vrste delcev ustvarja osmotski tlak v raztopini in s tem tudi njeno ime.
Število molov osmotično aktivnih delcev se imenuje Osmoles (predstavljen s simbolom OSM), zato je osmolarnost izražena v enotah OSM/L.
Pomen osmolarnosti
Osmolarnost je koncept velikega pomena za biologijo in medicino, saj je osmotsko ravnovesje celic z njihovim okoljem bistvenega pomena za njihovo preživetje. Na primer, vbrizgavanje raztopine z zelo visoko ali zelo nizko osmolarnostjo intravensko lahko bolniku zlahka povzroči smrt.
 Osmolarnost je bistven vidik rešitev v medicini in biologiji
Osmolarnost je bistven vidik rešitev v medicini in biologiji Po drugi strani je zelo pogosta tehnika, ki jo celični biologi uporabljajo za razbijanje celic različnih vrst, skozi osmotsko lizo. To je sestavljeno iz namestitve celic v hipotonično raztopino (z zelo nizko osmolarnostjo), tako da voda raztopine prodre z osmozo in jih počiva.
Zaradi tega je zelo pomembno, tako za zdravnike kot za biologe in strokovnjake z drugih področij, vedoč, merjenje ali znanje, kako izračunati osmolarnost rešitve.
Vam lahko služi: odstotna koncentracijaRazlike med osmolarnostjo in osmolalnostjo
Ko govorimo o osmolarnosti, je treba govoriti tudi o osmolalnosti. Osmolalnost je podobna osmolarnosti, na enak način kot morala je podobna molarnosti.
Medtem ko osmolarnost označuje Število osmolov na liter raztopine (OSM/L), Osmolalnost kaže enako, vendar Za vsak kilogram topila (OSM/kg).
Osmolalnost ima prednost, da ne odvisno od volumna raztopine, niti ni odvisno od gostote ali temperature. Zaradi tega bo imela rešitev enako osmolalnost pri 25 ° C kot pri 37 ° C. Po drugi strani bo njegova osmolarnost 37 ° C nekoliko nižja od njegove osmolarnosti pri 25 ° C, zaradi povečanja volumna toplotne ekspanzije.
Osmolalnost je običajno lažje meriti eksperimentalno kot osmolarnost. Vendar je osmolarnost lažje izračunati in je lažja enota za delo pri pripravi redčenja.
Kako se izračuna osmolarnost raztopine?
Obstaja več načinov za izračun osmolarnosti raztopine, odvisno od informacij, ki se štejejo. Izračuna se iz:
- Količine topljene in rešitve.
- Molarnost prisotnih topil.
- Posamezne koncentracije ionov.
- Med drugim odstotek M/V.
V vseh primerih izračun temelji na splošni formuli osmolarnosti, kar je:

Kje nOSM To je število osmolov, ki so prisotni v raztopini in Vsonce To je prostornina istega izraženega v litrih. Število osmolov se izračuna tako, da se pomnoži število molov v topljenci s številom delcev, v katerih disociira v raztopini.
Vam lahko služi: heterogene mešanice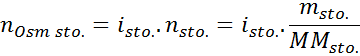
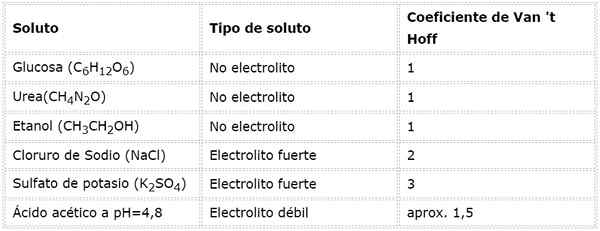
V tej enačbi, nsto To je število molov topljene, msto je njegova masa (v g), Mmsto Je njegova molarna masa (v g/mol) in Yosto Je koeficient van 't hoffa topila. Ta koeficient ima vrednost od 1 za topilo, ki neelektroliti (Na primer glukoza).
Za močne elektrolite, ki so popolnoma disociirani (na primer natrijev klorid, NaCl), je koeficient van 't Hoff enak skupnemu številu ionov, pri katerih vsak mol spojine disociitira.
Na primer v primeru kalijevega sulfata k2SW4, katere disociacijska reakcija je:
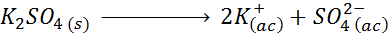
Vsak mol soli, ki se raztopi, ustvari 3 mole ionov (2 K ionov+ In 1 tako ion42-), torej I = n = 3.
V primeru šibkih elektrolitov je izračun bolj zapleten, vendar jih običajno določimo eksperimentalno. Naslednja tabela povzema koeficiente van 't hoffa za nekatere skupne topila.
Primeri izračuna osmolarnosti
1. Primer 1
Določite osmolarnost pripravljene raztopine z raztapljanjem 10 g NaCl in 10 g glukoze v 100 ml raztopine
Rešitev: V tem primeru se osmole vsake topljene izračunajo ločeno in nato dodajo. Molarne mase so 58,45 g/mol oziroma 180 g/mol, koeficienti ve 't hoff pa 2 in 1:
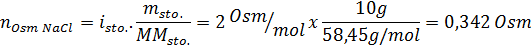
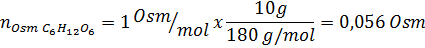
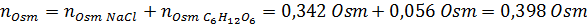
Zdaj izračunamo osmolarnost po formuli, saj vemo, da je 100 ml enaka 0,100L:
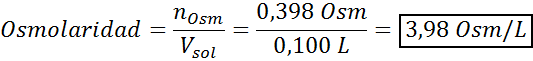
Končno je osmolarnost raztopine 3,98 OSM/L.
2. Primer 2
Določite osmolarnost mola 0,05 raztopine kalijevega sulfata.
Rešitev: Če že poznamo molarnost topljenega topljenega.
Vam lahko služi: benzaldehid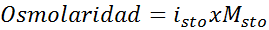
V tem primeru je faktor soli 3.
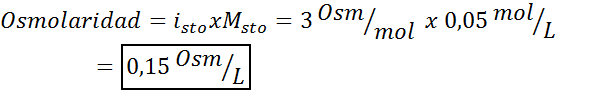
3. Primer 3
Določite osmolarnost vzorca plazme, ki vsebuje 0,125 M natrijevih ionov, 0,020 m kalijevih ionov in 0,145 kloridnih ionov.
Rešitev: Osmolarnost posameznih ionov je enaka njihovi molarnosti, saj ioni ne disociirajo več in imajo I = 1. Zaradi tega je v tem primeru potrebno le pomnožiti I = 1 Vsako koncentracijo in dodajte:
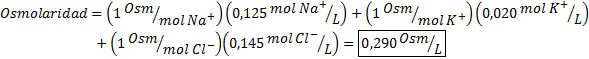
4. Primer 4
Izračunajte osmolarnost raztopine, ki vsebuje 27 mg kapice2.2H2Ali na vsakih 10 ml rešitve
Rešitev: Molekulska teža cochl2.2H2Ali pa je 147 g/mol. Pri raztapljanju se ta sol loči na 2 molekuli vode in tri ione. Vendar molekule vode niso osmotično aktivni delci, zato jih ne upoštevajo izračun osmolarnosti, koeficient te spojine pa 3.

5. Primer 5
Kakšna masa natrijevega klorida je potrebna za pripravo 3 litrov raztopine, katere osmolarnost je 1,20 OSM/L?
Rešitev: V tem primeru, ker se zahteva masa topljene in imamo prostornino in koncentracijo, je dovolj, da očistimo maso osmolarne formule.