Degenerirane orbitale

- 2026
- 495
- Cary Goyette
 Energetska shema z orbitali, ki jih zasedajo manjkajoči elektroni. Vir: Gabriel Bolívar
Energetska shema z orbitali, ki jih zasedajo manjkajoči elektroni. Vir: Gabriel Bolívar The Degenerirane orbitale So tisti, ki jih najdemo na isti ravni energije. Po tej definiciji morajo imeti enako glavno kvantno številko n. Tako so orbitale 2s in 2p degenerirane, saj spadajo v energijsko raven 2, čeprav je znano, da so njihove funkcije kotnih in radialnih valov različne.
Kot vrednosti n, Elektroni začnejo zasesti druge energijske podloge, na primer D in F orbitale.
Vsaka od teh orbitalov ima svoje značilnosti, ki jih na prvi pogled opazimo v njihovih kotnih oblikah; To so sferične figure (-e), dumbbells (p), listov detelje (d) in krogličnega (f).
Med njimi je energetska razlika, celo pripada isti ravni n.
Na primer, energetska shema z orbitali, ki jo zasedajo manjkajoči elektroni (nenormalni primer), je prikazana na zgornji sliki (nenormalni primer).
Vidimo, da je najbolj stabilna (najmanj energija) NS orbitala (1s, 2s, ...), medtem ko je NF najbolj nestabilen (tisti z največjo energijo).
Degenerirane orbitale izoliranega atoma
Degenerirane orbitale z enako vrednostjo kot n, So v isti vrsti v energetski shemi.
Zaradi tega so tri rdeče črte, ki simbolizirajo orbitale P, nameščene v isti črti; Kot na enak način naredite vijolične in rumene črte.
Slika shema krši pravilo umivalnika: orbitale večje energije so napolnjene z elektroni.
Vam lahko služi: kisline in baze: razlike, značilnosti, primeriKo se elektroni parijo, orbital izgubi energijo in izvede večjo elektrostatično odbojnost na manjkajoče elektrone drugih orbitalov.
Vendar takšni učinki niso upoštevani v mnogih energetskih diagramih. Če je tako in ubogate pravilo umivalnika, ne da bi popolnoma napolnili orbitale D, bi bilo videti, da nehajo biti degenerirani.
Kot je navedeno zgoraj, ima vsaka orbitala svoje lastnosti. Osamljeni atom s svojo elektronsko konfiguracijo je pripravljen na svoje elektrone v natančnem številu orbital, ki jim omogočajo, da jih gostijo.
Kot degenerirane je mogoče obravnavati samo tiste, ki so v energiji.
Orbitale str
Tri rdeče črte za orbitale slike slike kažejo, da sta oba px, strin In pz Imajo enako energijo.
V vsakem je izginil elektron, ki ga opisujejo štiri kvantne številke (n, l, ml in gospa), medtem ko prvi trije opisujejo orbitale.
Edina razlika med njimi označuje magnetni trenutek ml, ki nariše usmeritev Px Na osi x, strin na osi y in pz na osi z.
Trije so enaki, vendar se razlikujejo le v svojih prostorskih usmeritvah. Zaradi tega so vedno vlečeni v energijo, to je degenerirano.
Kot so enaki, inomotivni atom dušika (s konfiguracijo 1S22s22 p3) Tri orbitale morate obdržati degenerirane. Vendar se energetski scenarij naglo spremeni, če velja za atom N znotraj kemične molekule ali spojine.
Tako je, ker čeprav je Px, strin In pz V energiji so enaki, to se lahko razlikuje v vsaki od njih, če imajo različna kemična okolja; to je, če so povezani z različnimi atomi.
Vam lahko služi: izopreno: struktura, lastnosti, aplikacijeOrbitale d
Pet vijoličnih trakov označuje orbitale d. V izoliranem atomu, tudi če imajo seznanjene elektrone, veljajo, da je teh pet orbitalov degenerirano. Vendar za razliko od P orbital tokrat v njihovih kotnih oblikah obstaja izrazita razlika.
Zato njihovi elektroni potujejo v vesolju, ki se razlikujejo od ene orbitalne D do drugega.
To povzroča, glede na Teorija kristalnega polja, da minimalna motnja povzroči a Energija se odvija orbital; To pomeni, da se pet vijoličnih trakov loči in tako pušča energijsko vrzel med njimi:
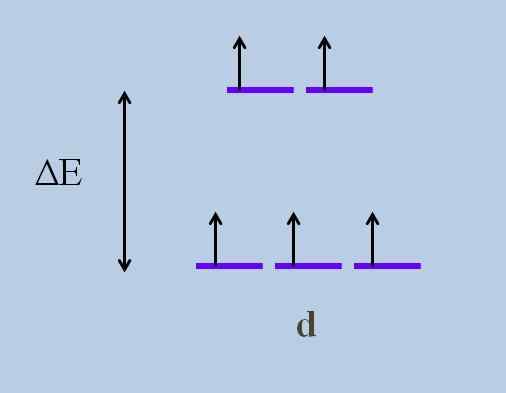 Shema odvijanja energije orbital. Vir: Gabriel Bolívar
Shema odvijanja energije orbital. Vir: Gabriel Bolívar Katere so zgornje orbitale in katere so spodaj? Tisti zgoraj so simbolizirani kot ing, in tiste spodaj t2 g.
Upoštevajte, kako so bile sprva poravnane vse vijolične črte, zdaj pa je nastal nabor dveh orbital ing več energije kot drugi sklop treh orbital t2 g.
Ta teorija omogoča razlago D-D prehodov, na katere se dodeli veliko barv, ki jih opazimo v spojinah prehodnih kovin (CR, MN, vera itd.).
Ta elektronska motnja je posledica koordinacijskih interakcij kovinskega središča z drugimi molekulami, imenovanimi Ligandi.
Orbitale f
In z orbitali F, sedmimi rumenimi črtami, je situacija še dodatno zapletena. Njeni prostorski naslovi se med njimi zelo razlikujejo, vizualizacija njihovih povezav pa postane preveč zapletena.
Pravzaprav velja, da so orbitale f tako notranje plasti, da pri oblikovanju povezav ne "bistveno sodelujejo".
Lahko vam služi: perklorični oksid (CL2O7)Ko je atom, izoliran z orbitali F, obkrožen z drugimi atomi, se začnejo in odvijanje medsebojnih interakcij (izguba degeneracije):
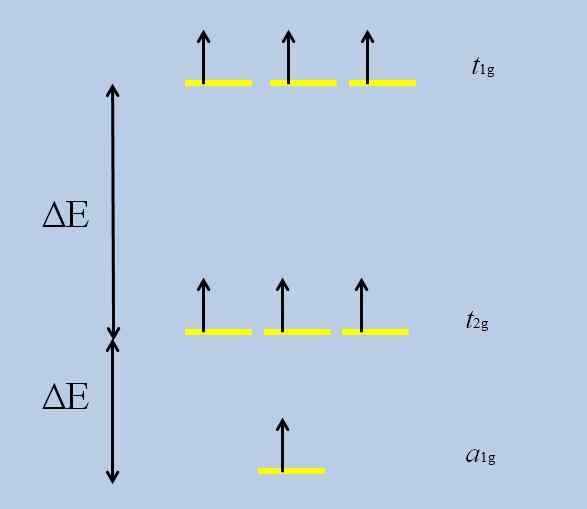 Shema izgube degeneracije. Vir: Gabriel Bolívar
Shema izgube degeneracije. Vir: Gabriel Bolívar Upoštevajte, da zdaj rumene črte tvorijo tri sklope: t1G, t2 g in do1G, In niso več degenerirani.
Degenerirane hibridne orbitale
Videti je bilo, da se orbitale lahko odvijajo in izgubljajo degeneracijo. Kljub temu, da to pojasnjuje elektronske prehode, ne pojasnjuje, kako in zakaj obstajajo različne molekularne geometrije. Tu vstopijo hibridne orbitale.
Njegova glavna značilnost je, da so degenerirani. Tako izhajajo iz mešanice orbitalnih znakov s, p, d in f, da povzročajo degenerirane hibride.
Na primer, tri p orbitale se mešajo z enim S, da dajo štiri Orbitale SP3. Vse sp orbitale3 So degenerirani in imajo zato enako energijo.
Če sta tudi dve orbitali pomešani s štirimi SP3, Pridobljenih bo šest orbital3d2.
In kako pojasnjujejo molekularne geometrije? Ker jih je šest, z enakimi energijami, jih je treba v prostoru simetrično usmeriti, da ustvarijo enaka kemična okolja (na primer v MF spojini6).
Ko to storijo, se oblikuje oktaeder usklajevanja, ki je enak oktaedrski geometriji okoli središča (m).
Vendar geometrije ponavadi predstavljajo izkrivljanja, kar pomeni, da tudi hibridne orbitale niso popolnoma degenerirane.
Zato kot zaključek obstajajo degenerirane orbitale le v izoliranih atomih ali zelo simetričnem okolju.
Reference
- Opredelitev degeracije. Okrevano od: Chemicool.com
- Atomi in atomske orbitale. Okreval od iskric.com
- Whitten, Davis, Peck & Stanley. Kemija. (8.ª Ed.). Cengage učenje.

