Nukleofilni nukleofilni napad, tipi, primeri, nukleofilnost
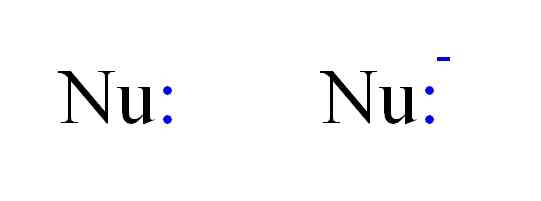
- 4065
- 392
- Dexter Koch
A nukleofil Vse atom, ion ali molekula želi darovati pare elektronov v snovi s pozitivnimi obremenitvami ali regijami. Beseda pomeni "ljubezen do jeder". Kadar je atom ali molekularno območje v elektroni slabo, doživi silo večje privlačnosti z atomskimi jedri; In natančno ta privlačnost privablja nukleofile.
Zato morajo biti nukleofili negativne vrste, kot so nasprotni znaki, nukleofili; ali vsaj imeti zelo negativne regije zaradi lokalne ali razpršene koncentracije elektronov.
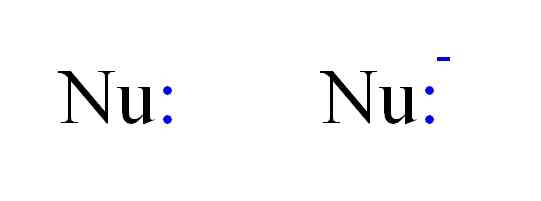 Dve najpogostejši vrsti nukleofilov v kemiji. Vir: Gabriel Bolívar.
Dve najpogostejši vrsti nukleofilov v kemiji. Vir: Gabriel Bolívar. Tako je lahko nukleofil predstavljen s črkami NU, kot na zgornji sliki. Dvojne točke v modri barvi ustrezajo nekaj elektronom, ki dajejo elektrofilu; To je, atom ali slaba molekula elektronov. Upoštevajte, da je nukleofil lahko nevtralen ali anionski, vendar oba podarita pare elektronov.
Napad nukleofilov na elektrofilce je temelj neštetih reakcij in organskih mehanizmov. Primer nukleofila je hidroksilni anion, OH-, ki se obnaša tudi kot baza. Vendar nukleofilnosti nikoli ne bi smeli zamenjati z osnovno snovjo.
[TOC]
Nukleofilni napad
Nukleofili izgledajo. Naslednja kemična enačba predstavlja napad nukleofila:
Wildebeest: + R-LG → R-NU + LG:
Nucleophile NU: podari svoj par elektronov A R, ki je povezan z elektronegativno LG skupine. Pri tem je povezava R-LG pokvarjena, LG-jeva emigra :, in nova povezava R-NU je oblikovana. To je osnova za številne organske reakcije.
V naslednjem razdelku bo videti, da je nukleofil lahko celo aromatičen obroč, katerega elektronska gostota je razpršena v njegovem središču. Prav tako lahko nukleofil postane sigma vez, kar pomeni, da se elektroni istega izselijo ali skočijo v bližnje jedra.
Vam lahko postreže: kalijev kromat (K2CRO4)Vrste nukleofilov
Obstaja več vrst nukleofilov, vendar velike velike.
Vrste z brezplačnimi pari elektronov
Ko govorimo o vrstah s prostimi elektronskimi pari, se nanašamo na anione ali molekule z elektronegativnimi atomi, kot so kisik, dušik in žveplo. V razdelku Primeri bodo vidni številni nukleofili, razen Aniona OH- že omenjeni.
Dvojne povezave
Nukleofil ima lahko dvojne vezi, ki so odgovorni za nukleofilni napad. Vendar morajo biti dvojne vezi z opazno elektronsko gostoto, zato ne bo nobena molekula, ki jih ima, močna nukleofila; to pomeni, da ne bo imela visoke nukleofilne.
Na primer, razmislite o benzenskem obroču v naslednji reakciji alkilacije (reakcija Friedel-Crafts):
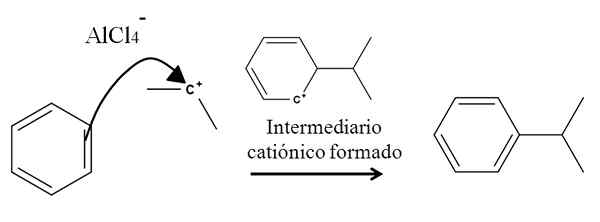 Benzenska alkilacija pri aromatični elektrofilni substituciji. Vir: Gabriel Bolívar.
Benzenska alkilacija pri aromatični elektrofilni substituciji. Vir: Gabriel Bolívar. Prisotnost mešanice ALCL3-(Pogl3)2CHCL izvira iz izopropil karbokacije. Njegova pozitivna obremenitev in nestabilnost močno pritegnejo elektrone ene od dvojnih vezi benzena, ki napadajo karbokacijo, kot jo predstavlja puščica.
V tem procesu se oblikuje kratek kationski in aromatični medmadiarni, ki se končno spremeni v pravi izdelek.
Kot tudi pri benzenu lahko druge snovi z dvojnimi vezmi delujejo kot nukleofili, pod pogojem, da so reakcijski pogoji najprimernejši. Prav tako morajo biti v bližini dvojne vezi, ki podarijo elektronsko gostoto, na voljo atomi, tako da se "napolnijo" elektronov.
SIGMAS povezave
Sigma vezi kot take niso nukleofili; Vendar se lahko obnaša kot tako, ko se začne reakcija in se začne mehanizem. Razmislite o naslednjem primeru:
Lahko vam služi: Linding Salts: kaj so, nomenklatura, lastnosti, primeri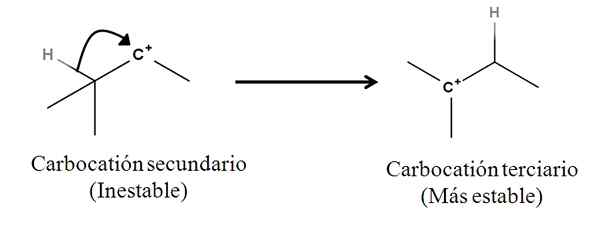 Pretvorba sekundarne v terciarno karbokacijo z migracijo iz hidridnega aniona. Vir: Gabriel Bolívar.
Pretvorba sekundarne v terciarno karbokacijo z migracijo iz hidridnega aniona. Vir: Gabriel Bolívar. SIGMA C-H vez, ki meji na karbokacijo, se premakne proti njemu in se obnaša kot nukleofil (glej gibanje ukrivljene puščice). V tem smislu je rezultat, da se anion h premika- do sosednjega ogljika, vendar tako hitro, da se upošteva sigma vez in njegov par elektronov kot nukleofilno sredstvo tega mehanizma.
Primeri nukleofila
V tem razdelku bo omenil več primerov prve vrste nukleofilov, ki so zelo obilni in pomembni v organski in anorganski kemiji.
Halogenuros
Halogenuros (f-, Cl-, Br- in jaz-) So nukleofili. Morajo podariti enega od svojih štirih parov valenčnih elektronov. Odvisno od hitrosti, s katero eden od teh halogenuros napade elektrofijo, bo imela večjo ali manjšo nukleofilnostjo.
Na splošno i- Je boljši nukleofil kot f- in drugi halogenuros, saj je lažje oblikovati kovalentno povezavo, ker je bolj polariziran; To pomeni, da je bolj zajetno in z manj trdosti, da se odreče svojemu paru elektronov.
Molekule elektronegativnega atoma
 Molekule vode
Molekule vode Voda, HAH, je nukleofil, ker ima atom kisika visoko negativno gostoto in prosti pari elektronov, da daruje in tvori kovalentno vez. Tudi alkoholi, roh, so nukleofili iz istih razlogov kot tisti iz vode.
Majhne dušikove molekule, kot je amoniak, NH3, Ponavadi so tudi nukleofili. To je zato, ker lahko dušik podari svoj samotni par elektronov. Podobno, amines, RNH2, So tudi nukleofili.
In poleg majhnih molekul s kisikom ali dušikom se tudi žvepla štejejo za nukleofile. To je primer vodikovega sulfida, h2S, in tiole, rsh.
Žveplo je boljši nukleofil kot kisik in dušik, ker se manj "oprime" v par elektronov, zato ga je lažje podariti. K temu dejstvu je treba dodati tudi, da je njen atom bolj obsežen, to je bolj polariziran in zato sposoben oblikovati kovalentne vezi z manj težav.
Lahko vam služi: Mohr metoda: osnove, reakcije, postopek, uporabeAnioni
Kisigenirani, dušik, sulfurizirani anioni in na splošno je več močnih nukleofilov. To je zato, ker imajo zdaj negativno obremenitev, ki še okrepi prisotnost para elektronov, ki jih bodo podarili.
Razmislite na primer naslednje anione, postavljene v zmanjšanju vrstnega reda nukleofilnosti:
: Pog3- >: NH2- >: Oh- >: F-
Karboanion ch3- Je najmočnejši nukleofil, ker ogljikov atom ne stabilizira negativne obremenitve, katerih elektroni so "obupni" v bližnjih jedrih. To se ne zgodi z Amiduro, NH2-, katerega dušikovni atom bolje stabilizira negativno obremenitev in daje par elektronov lažje kot OH- ali f-.
Nukleofilnost
Nukleofilnost določa, kako močan je nukleofilni značaj vrste. To je odvisno od številnih dejavnikov, najpomembnejša pa je sterična ovira med nukleofilnim napadom in delovanjem topila.
Manjši je nukleofil, hitrejši in učinkovit bo vaš elektrofilski napad. Tudi, koliko nižje interakcije med topilom in nukleofilom. Zato v skladu s tem i- ima večjo nukleofilnost kot F-.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10. izdaja.). Wiley Plus.
- James Ashenhurst. (2020). Trije razredi nukleofilov. Okrevano od: mastersorganicChemistry.com
- Profesor Patricia Shaley. (2012). Nukleofili in elektrofili. Univerza v Illinoisu. Okreval od: butana.Kem.Uiuc.Edu
- Wikipedija. (2020). Nukleofil. Pridobljeno iz: v.Wikipedija.org
- Čelada, Anne Marie, ph.D. (11. februar 2020). Opredelitev nukleofila v kemiji. Okreval od: Thoughtco.com
- Rachael Curtis. (5. junij 2019). Nukleofil. Kemija librettexts. Okrevano od: kem.Librettexts.org
- « Lastnosti termodinamičnega sistema, vrste, primeri
- Koncept, značilnosti in primeri enakovredne pripovedovalke »

