Spektralna zapis

- 2294
- 208
- Lee Farrell
 Tabela, ki označuje ravni in orbitale
Tabela, ki označuje ravni in orbitale Kaj je spektralna zapis?
The Spektralna zapis To je razporeditev elektronov na ravni energije okoli jedra atoma. Po Bohrjevem starem atomskem modelu elektroni zasedajo več nivojev v orbiti okoli.
V smislu bolj rafiniranega kvantno mehanskega modela so plasti K-Q razdeljene na niz orbitalov, od katerih je vsak mogoče zasesti največ nekaj elektronov.
Običajno se elektronska konfiguracija uporablja za opisovanje orbitalov atoma v svojem temeljnem stanju, vendar jo lahko uporabimo tudi za predstavljanje atoma, ki je bil ioniziran v kationu ali anionu, ki kompenzira z izgubo ali pridobivanjem elektronov v njihovih orbitalih.
Številne fizikalne in kemijske lastnosti elementov je mogoče povezati z njihovimi edinstvenimi elektronskimi konfiguracijami. Valencia Electrons, elektroni v najbolj oddaljenem sloju, so odločilni dejavnik za edinstveno kemijo elementa.
Ko elektroni najbolj oddaljene plasti atoma prejmejo energijo od neke vrste, se premaknejo na večje energijske plasti. Tako se bo elektron v plasti K prenesel v plast l v stanju največje energije.
Ko se elektron vrne v svoje temeljno stanje, sprosti energijo, ki jo je absorbirala z oddajanjem elektromagnetnega spektra (svetloba). Ker ima vsak atom določeno elektronsko konfiguracijo, bo imel tudi specifičen spekter, ki se imenuje absorpcijski (ali emisijski) spekter.
Zaradi tega se izraz spektralni zapis uporablja za navajanje elektronske konfiguracije.
Kako določiti spektralno zapisovanje: kvantne številke
Skupno štiri kvantne številke se uporabljajo za popolno opisovanje gibanja in usmeritev vsakega elektrona znotraj atoma.
Kombinacija vseh kvantnih števil vseh elektronov v atomu opisuje valovno funkcijo, ki ustreza Schrödingerjevi enačbi. Vsak elektron v atomu ima edinstven nabor kvantnih številk.
Lahko vam služi: molarna frakcija: kako je izračunana, primeri, vajePo Paulijevem načelu izključitve dva elektrona ne moreta deliti enake kombinacije štirih kvantnih številk.
Kvantne številke so pomembne, ker jih lahko uporabimo za določitev elektronske konfiguracije atoma in verjetne lokacije atomskih elektronov.
Kvantne številke se uporabljajo tudi za določitev drugih značilnosti atomov, kot sta ionizacijska energija in atomski polmer.
Kvantne številke označujejo posebne lupine, podkape, orbitale in elektroni.
To pomeni, da v celoti opišejo značilnosti elektrona v atomu, to je, da opisujejo vsako posamezno rešitev Schrödingerjeve enačbe ali valovne funkcije, elektrone v atomu.
Skupno so štiri kvantne številke: glavno kvantno število (n), kvantno število orbitalnega kota (L), magnetno kvantno število (ml) in kvantno število vrtenja elektronov (MS).
Glavna kvantna številka, NN, opisuje energijo elektrona in najverjetnejšo razdaljo jedrnega elektrona. Z drugimi besedami, nanaša se na velikost orbitala in ravni energije, v kateri je postavljen elektron.
Število podkapov ali LL opisuje obliko orbitala. Uporablja se lahko tudi za določitev števila kotnih vozlišč.
Magnetna kvantna številka ML opisuje raven energije v podkapu in se še več nanaša na vrtenje na elektronu, ki je lahko navzgor ali navzdol.
Načelo Aufbau
Aufbau prihaja iz nemške besede Aufbauen, Kaj pomeni "graditi". V bistvu pri pisanju konfiguracij elektronov gradimo elektronske orbitale, ko napredujemo iz enega atoma v drugega.
Ko zapišemo elektronsko konfiguracijo atoma, bomo orbitale napolnili v naraščajočem vrstnem redu atomskega števila.
Načelo Aufbau izvira iz načela izključitve Paulija, ki pravi, da v atomu ni dveh fermionov (na primer elektronov).
Lahko vam služi: batirna kislina: formula, lastnosti, tveganja in uporabeImajo lahko enak nabor kvantnih števil, zato se morajo "kopičiti" pri višji ravni energije. Kako se elektroni nabirajo, je tema nastavitev elektronov.
Stabilni atomi imajo toliko elektronov, kot to počnejo protoni v jedru. Elektroni se zbirajo okoli jedra v kvantnih orbitalih po štirih osnovnih pravilih, imenovanih načelo Aufbau.
1. V atomu ni dveh elektronov, ki bi si delila iste štiri kvantne številke n, l, m in s.
2. Elektroni bodo najprej zasedli orbitale najnižje ravni energije.
3. Elektroni bodo orbitale vedno napolnili z isto vrtečo številko. Ko so orbitale polne, se bo začelo.
4. Elektroni bodo napolnili orbitale za vsoto kvantnih števil n in l. Orbitale z enakimi vrednostmi (n + l) bodo najprej napolnjene z nižjimi N vrednostmi.
Drugo in četrto pravilo sta v bistvu enaka. Primer štirih pravil bi bila orbitala 2p in 3s.
Orbitalna 2p je n = 2 in l = 2 in a 3s orbitala je n = 3 in l = 1. (N + l) = 4 v obeh primerih, vendar ima 2P orbital najnižjo energijo ali nižjo vrednost in bo napolnjena pred plastjo 3S.
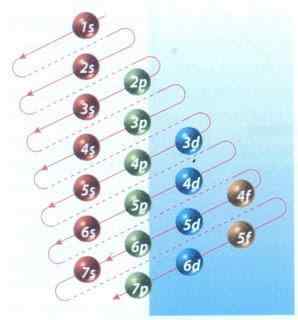 Slika 2: Moellerjev diagram elektronskega konfiguracijskega polnjenja
Slika 2: Moellerjev diagram elektronskega konfiguracijskega polnjenja Na srečo lahko uporabite Moellerjevo diagram, prikazan na sliki 2, da napolnite elektrone. Graf se bere tako, da izvedemo diagonale iz 1S.
Slika 2 prikazuje atomske orbitale in puščice označujejo način sledenja.
Zdaj, ko je znano, da je vrstni red orbital napolnjen.
Orbitale imajo 1 možno vrednost ml Vsebovati 2 elektrona
P orbitale imajo 3 možne vrednosti ml Vsebovati 6 elektronov
Orbitale imajo 5 možnih vrednosti ml Vsebovati 10 elektronov
F orbitale imajo 7 možnih vrednostil Vsebovati 14 elektronov
To je vse, kar je potrebno za določitev elektronske konfiguracije stabilnega atoma elementa.
Vam lahko služi: dodecil natrijev sulfat (SDS): struktura, lastnosti, uporabeNa primer, vzemite element dušika. Dušik ima sedem protonov in torej sedem elektronov. Prva orbitala, ki jo je treba izpolniti, je orbital 1s. Orbital S ima dva elektrona, zato je ostalo še pet elektronov.
Naslednja orbitala je 2S orbitala in vsebuje naslednja dva. Trije končni elektroni bodo odšli v orbitalo 2P, ki lahko vsebuje do šest elektronov.
Pravila umivalnika
V razdelku Aufbau so razpravljali o tem, kako elektroni najprej napolnijo najnižje energetske orbitale in se nato premaknejo na najvišje energijske orbitale šele po tem, ko so orbitale nižje energije polne.
Vendar obstaja težava s tem pravilom. Zagotovo je treba orbitale 1 napolniti pred 2s orbitali, ker imajo 1s orbitale nižjo vrednost n in s tem nižjo energijo.
In tri različne orbitale? V katerem vrstnem redu bi morali izpolniti? Odgovor na to vprašanje vključuje pravilo potovanja.
Pravilo umivalnika ugotovi, da:
- Vsaka orbitala v nivoju je zasedena posamično, preden je kakršna koli orbitala dvakrat zasedena.
- Vsi elektroni v individualno zasedenih orbitalih imajo enak zavoj (da povečajo skupni zavoj).
Ko so elektroni dodeljeni orbitalom, si elektron najprej želi napolniti vse orbitale s podobno energijo (imenovano tudi degenerirane orbitale), preden se v pol -polni orbitali ujema z drugim elektronom.
Atomi v zemeljskih stanjih imajo čim več elektronov, čim več neizpolnjenih. Ko vizualiziramo ta postopek, razmislite, kako elektroni kažejo enako vedenje kot isti drogovi v magnetu.
Ko negativno napolnjeni elektroni napolnijo orbitale, se najprej poskušajo čim bolj pobegniti, preden se morajo ujemati.
Reference
- Kvantne številke. Kem je okreval.Librettexts.org.
- Konfiguracije elektronov in lastnosti atomov.F.). Opomogel od enetonte.Edu.
- Elektronska konfiguracija. Okreval od Britannice.com.

