Brez zgodovine kovin, lastnosti, skupin, uporabe

- 4034
- 375
- Raymond Moen
The brez kovin So skupina elementov, ki se nahajajo na desni strani periodične tabele, z izjemo vodika, ki se nahaja v skupini 1 (AI), skupaj z alkalnimi kovinami. Če želite vedeti, kaj so, morate pogledati zgornji desni kot blok P.
Ne -kometalni atomi so razmeroma majhni, njihova zunanja elektronska plast pa ima povišano število elektronov. Med nemetalnimi elementi najdemo trdne snovi, tekočine in pline; Čeprav so večinoma v plinastem stanju, jih je nekaj obogatilo v ozračju.
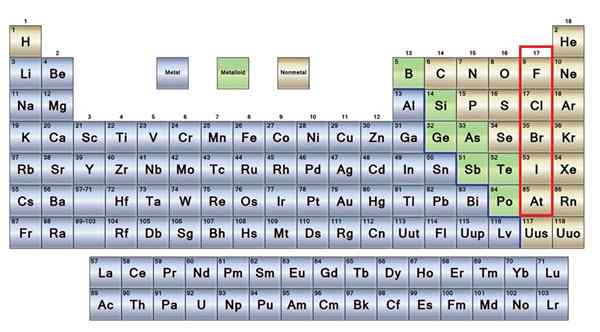 Ne -metalni elementi v rjavi barvi
Ne -metalni elementi v rjavi barvi Dober del nemetal je prisoten pri vseh živih bitjih v obliki spojin in makromolekul. Na primer: ogljik, kisik in vodik so prisotni v vseh beljakovinah, lipidih, ogljikovih hidratih in nukleinskih kislinah.
Fosfor je prisoten v vseh nukleinskih kislinah in v nekaterih ogljikovih hidratih in lipidih. Žveplo najdemo v številnih beljakovinah. Dušik je del vseh nukleinskih kislin in beljakovin.
Po drugi strani so podzemni plini in naftne surovine skoraj sestavljeni iz ne -metalnih elementov. Pravzaprav ogljikovodiki (ogljik in vodik) dajejo predstavo o tem, kako obilne so ne -komele kljub manjšemu številu elementov v periodični tabeli.
[TOC]
Zgodovina
Od antike (3750 do.C.) Egipčani so uporabili premog za zmanjšanje bakra, ki je prisoten v svojih mineralih, kot sta Corvelita in Malahit.
Leta 1669 je Brand Hennin uspel izolirati zbrani fosfor urina. Henry Cavendish (1776) je dosegel identifikacijo vodika, čeprav je več raziskovalcev, vključno z Robertom Boyleom (1670), ustvarilo vodik z reakcijo močne kisline s kovino.
Carl Scheele je proizvajal kisik s segrevanjem živega oksida z nitrati (1771). Curtois je uspel izolirati joda, medtem ko je poskušal pripraviti soli iz morskih alg (1811). Balard in Gmelin sta izolirala Bome (1825).
Leta 1868 sta Janssen in Lockger Independent. Moissanu je uspel izolirati fluorid (1886).
Leta 1894 sta lord Rayleigh in Ramsey odkrila Argon s preučevanjem lastnosti dušika. Ramsay in Travers (1898) so s kriogeno destilacijo zraka izolirali kripto, neonsko in ksenon tekočega argona.
Fizikalne in kemijske lastnosti
 Žveplo je eden najbolj reprezentativnih nemetalnih elementov. Vir: Ben Mills prek Wikipedije.
Žveplo je eden najbolj reprezentativnih nemetalnih elementov. Vir: Ben Mills prek Wikipedije. Fizično
Nekatere fizikalne lastnosti ne -kometa so:
-Imajo nizko električno prevodnost, razen ogljika v obliki grafita, ki je dober električni prevodnik.
Vam lahko služi: Heptano (C7H16): struktura, lastnosti in uporabe-Pojavijo se lahko pod fizičnim videzom trdnih snovi, tekočin ali plinov.
-Imajo nizko toplotno prevodnost, razen ogljika v obliki diamanta, ki se ne obnaša kot toplotni izolator.
-Imajo malo sijaja, za razliko od kovinske svetlosti kovine.
-Ne kovinske trdne snovi so krhke, zato niso noben ali pobožni.
-Imajo nizke točke in vrelišča.
-Lahko predstavljajo različne kristalne strukture. Tako imajo fosfor, kisik in fluorid kubično kristalno strukturo; Vodik, ogljik in dušik, šesterokotni; in žveplo, klor, bromin in jod, ortorrombic.
Kemija
Za ne kovine so značilni, da imajo visoko ionizacijsko energijo in visoko vrednost elektronegativnosti. Fluor ima na primer največjo elektronegativnost (3,98), ki je najbolj reaktiven element ne -komelalcev.
Toda presenetljivo je, da imata plemenita plini Helij (5,5) in Neon (4,84) največjo elektronegativnost. Vendar so kemično inertni, ker imajo zunanje elektronske plasti polne.
Ne kovine tvorijo ionske spojine s kovinami in kovalentno z ne -kovini.
Ne -metalni elementi tvorijo diatomske molekule, povezane s kovalentnimi vezmi. Medtem so atomi plemenitih plinov v obliki atomskih enot.
Tvorijo kisline okside, ki reagirajo z vodo, ki izvirajo iz kislin.
Skupine, ki niso kovine in elemente

Skupina 1
Sestavlja ga vodik brezbarven in toaletni plin, dialetomski. Oksidacijsko stanje +1. Ima manj gostote kot zrak. V trdnem stanju predstavlja šesterokotno kristalno strukturo. Vodik je malo reaktivni element.
Skupina 14
Carbon je edini ne -metal, ki pripada tej skupini. Ogljik v obliki grafita je bujna trdna snov, s šesterokotno kristalno strukturo. Ima visoko električno prevodnost. Njegova najpogostejša stanja oksidacije so +2 in +4.
Skupina 15
Dušik
Brezbarven in toaletni plin. Je malo reaktivni element in rahlo gostejši od zraka. Pogostejša stanja oksidacije: -3 in +5. Tvori diatomske molekule, n2.
Ujemanje
Trdna, njegova barva je lahko bela, rumena ali črna. Malo reaktivno. Ortorrombična kristalna struktura. Elektronegativnost 2,1. Pogostejša stanja oksidacije: -3 in +5.
Skupina 16
Kisik
Brezbarven plin ali bledo modra, stranišče. Na splošno ni reaktivno. Kubična kristalna struktura. Je izolator in močno oksidacijsko sredstvo. Elektronegativnost 3.5. Oksidacijsko stanje -2
Žveplo
Svetlo rumena trdna, krhka, zmerno reaktivna. Ortorrombična kristalna struktura. Oblikujejo kovalentne vezi. Elektronegativnost 2.5. Pogostejša stanja oksidacije: -2, +2, +4 in +6.
Selen
Črno siva ali rdečkasto trdna. Sivi selen kaže svetlobno občutljivo električno prevodnost. Je mehka in krhka trdna. Elektronegativnost 2.4. Oksidacijska stanja: -2, +2, +4 in +6.
Vam lahko služi: kalijev hidroksid: struktura, lastnosti, uporabeSkupina 17
Fluor
Je bledo rumen plin, zelo strupen. Je zelo reaktiven element. Predstavljena je kot diatomske molekule, F2. V trdnem stanju kristalizira v kubični obliki. Elektronegativnost 3.98. Stanja oksidacije -1.
Klor
Je zeleno-rumen plin. Predstavlja diatomske molekule, CL2. Je zelo reaktivno. V trdnem stanju je kristalna struktura ortorrombična. Elektronegativnost 3.0. Oksidacijska stanja: - 1, +1, +3, +5, +7.
Bromin
To je tekočina z rdečo kavarno. Elektronegativnost 2.8. Oksidacijska stanja -1, +1, +3, +5 in +7.
Jod
Črna trdna snov je, da ko sublimate oddaja vijolično paro. Ortorrombična kristalna struktura. Kovinski jodidi so ionski. Elektronegativnost 2.5. Oksidacijska stanja: -1, +1, +3, +5, y +7.
Astato
Je črna trdna. Kubična kristalna struktura, osredotočena na obraz. Elektronegativnost 2,2. Je šibko oksidacijsko sredstvo.
Skupina 18
Helija
Ima visoko toplotno prevodnost. Elektronegativnost 5.5. Je kemično inerten in ni vnetljiv. Nizka gostota in visoka tekočnost.
Neon
Visoka hladilna zmogljivost v tekočem stanju. Elektronegativnost 4.84. Je najmanj reaktiven za plemenite pline.
Argon
Je gostejši od zraka. Kemično inerten. Elektronegativnost 3.2.
Krypton
Elektronegativnost 2.94. Lahko reagira s fluoridom, da tvori kriptonski difluorid (KRF2).
Ksenon
Prečka krvno možgansko pregrado. Se odziva na svetlobo za proizvodnjo električnega toka. Elektronegativnost 2,2. Kompleksna oblika s fluorom, zlatom in kisikom.
Radon
To je radioaktivni element. Elektronegativnost 2.06. Tvorijo spojine s fluoridom (RNF2) in s kisikom (RNO3).
Prijave
Vodik

Uporablja se v raketnem pogonu in kot gorivo v avtomobilskih motorjih, ki uporabljajo vodik. Uporablja se v sintezi amoniaka (NH3) in v hidrogenaciji maščob.
Ogljik
Grafit se uporablja pri izdelavi svinčnikov in vlaken z visoko odmevnostjo, ki se uporabljajo pri izdelavi športnih člankov. Diamant se uporablja kot dragulj z veliko vrednostjo in v vrtalnih vrtalnicah kot abrazivni. Ogljikov dioksid se uporablja pri izdelavi brezalkoholnih pijač.
Dušik
Uporablja se pri proizvodnji amoniaka, dušikove kisline in sečnine. Dušik je bistven element za rastline in se uporablja pri proizvodnji gnojil.
Ujemanje
Beli fosfor se uporablja kot raticid, insekticid in v pirotehnični industriji. Rdeči fosfor se uporablja pri proizvodnji tekme. Njegove spojine se uporabljajo tudi pri izdelavi gnojil.
Kisik
Kisik se uporablja pri izdelavi jekla, plastike in tekstila. Uporablja se tudi pri raketi, terapiji s kisikom in dihanju pri zrakoplovih, podmornicih in vesoljskih letih.
Vam lahko služi: erbio: struktura, lastnosti, pridobivanje, uporabeŽveplo
Uporablja se kot surovina za proizvodnjo žveplove kisline, smodnika in pri vulkanizaciji gumic. Sulfiti se uporabljajo za beljenje papirja in fungicida.
Selen
Uporablja se za dajanje škrlatne rdeče obarvanosti na kozarec. Uporablja se tudi za nevtralizacijo zelenkastega odtenka, ki ga proizvaja steklo z železnimi spojinami. Uporablja se v fotoelektričnih celicah z uporabo na vratih in dvigalih.
Fluor

Dodamo se v zobne kreme, da se prepreči karies. Vodikov fluorid se uporablja kot surovina za teflon. Monoatomski fluoror se uporablja pri proizvodnji polprevodnikov.
Klor
Uporablja se v ekstraktivni metalurgiji in ogljikovodikovih kloriranju za proizvodnjo raznolikih izdelkov, kot je PVC. Klor se uporablja pri beljenju lesa in tekstilne celuloze. Uporablja se tudi kot vodno razkužilo.
Bromin
Uporablja se pri pripravi srebrnega bromida za svetlobne leče, v fotografskih filmih.
Jod
Za preprečevanje ščitničnega goiterja se doda kalijev jodid (ki). Tinktura joda se uporablja kot antiseptik in mamicid. Jod je del ščitničnih hormonov.
Helija
Uporablja se pri polnjenju balonov vročega zraka in pomešamo s kisikom za globoko dihanje vode. Uporablja se za zvare v inertni atmosferi in pomaga vzdrževati zelo nizke raziskovalne temperature.
Neon
V steklenih ceveh, ki se prižgejo za delovanje električne energije (neonske rdeče luči).
Argon
Uporablja se za ustvarjanje ozračja za varjenje in pri polnjenju žarišč.
Ksenon
Pri proizvodnji utrinkov velike intenzivnosti na kratkoročni fotografski razstavi se uporablja mešanica ksenona in kriptona.
Radon
Uporablja se pri zdravljenju rakavih tumorjev z radioterapijo.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Mathews, c. K., Van Holde, k. In. In ahern, k. G. (2002). Biokemija. Tretja izdaja. Uredi. Pearson-Addison Wesley
- Čelada, Anne Marie, ph.D. (6. oktober 2019). Kakšne so lastnosti nemetal? Okreval od: Thoughtco.com
- Wikipedija. (2019). Nemetal. Pridobljeno iz: v.Wikipedija.org
- Uredniki Enyclopeedia Britannica. (5. april 2016). Nemetal. Encyclopædia Britannica. Okrevano od: Britannica.com
- Jose m. Gavira Vallejo. (27. januar 2016). Kaj so pnikogeni? In ikosogenos, kristalogeni, kalkogeni .. ? Pridobljeno iz: Triplenlace.com
- « Zgodovina fluore, lastnosti, strukture, pridobivanje, tveganja, uporabe
- Kaj so, vrste in značilnosti »

