Zgodovina fluore, lastnosti, strukture, pridobivanje, tveganja, uporabe
- 872
- 49
- Mr. Shane Larkin
On fluor Gre za kemični element, ki je predstavljen s simbolom F in Heads Group 17, ki mu pripadajo halogeni. Razlikuje se nad drugimi elementi periodične tabele, ker je najbolj reaktiven in elektronegativen; reagira skoraj z vsemi atomi, zato tvori nešteto soli in organizacijskih spojin.
V normalnih pogojih je bledo rumen plin, ki ga je mogoče zamenjati z rumenkasto zeleno. V tekočem stanju, prikazano na spodnji sliki, se njena rumena barva nekoliko poveča, kar popolnoma izgine, ko se utrdi v svoji zamrzovalni točki.
 Tekoči fluor v epruveti. Vir: fulvio314 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]
Tekoči fluor v epruveti. Vir: fulvio314 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] To je takšna reaktivnost, kljub nestanovitnemu plinu, ki ostane ujet v zemeljsko skorjo; zlasti v obliki fluoritskega minerala, znanega po svojih vijoličnih kristalih. Prav tako je zaradi njegove reaktivnosti potencialno nevarna snov; Močno reagirajte z vsem, kar se dotakne in gori v plamenu.
Vendar so številni njegovi izpeljani izdelki lahko neškodljivi in celo koristni, odvisno od njihovih aplikacij. Na primer, najbolj priljubljena uporaba fluorida, dodana v ionsko ali mineralno obliko (na primer fluoridne soli), je sestavljena iz priprave zobnih past s fluoridom, ki pomagajo zaščititi zobno sklenino.
Fluor predstavlja posebnost, ki se lahko stabilizira veliko število ali oksidacijska stanja za številne druge elemente. Večje kot je število fluorovih atomov, bolj reaktivna bo spojina (razen če gre za polimer). Prav tako se bodo njegovi učinki z molekularnimi matricami povečali; za boljše ali slabše.
[TOC]
Zgodovina
Uporaba fluorita
Leta 1530 je nemški mineralogist Georgius Agricola odkril, da je mogoče pri čiščenju kovin uporabiti mineral Fluorspar. Fluorspar je drugo ime za fluorit, mineral fluora, ki je bil sestavljen iz kalcijevega fluorida (CAF2).
Fluorovega elementa do takrat ni odkril in "fluoir" v fluoritu je prišel iz latinske besede "fluere", kar pomeni "pretok"; Ker je to storil Fluorspar ali fluorit s kovinami: pomagal jim je zapustiti vzorec.
Priprava fluorhorične kisline
Leta 1764 je upravljal Andreas Sigismud Margraff. Steklene vrnitve, ki se stopijo z delovanjem kisline, zato so steklo nadomestile kovine.
Pripisujemo ga tudi Carl Scheele leta 1771, priprava kisline po isti metodi, ki ji sledi Margraff. Leta 1809 je francoski znanstvenik Andre-Marie Ampere predlagal, da je fluorna ali fluorhorična kislina spojina, ki jo tvori vodik in nov element, podoben kloru.
Znanstveniki so že dolgo poskušali izolirati fluor z uporabo fluorhorične kisline; Toda njegova nevarnost je v zvezi s tem napredovala.
Humphry Davy, Joseph Louis Gay-Lussac in Jacques Thénard so imeli močne bolečine pri vdihavanju vodikovega fluorida (fluoridna kislina brez vode in v plinasti obliki)). V podobnih okoliščinah sta znanstvenika Paulin Louyet in Jerome Nickles umrla z zastrupitvijo.
Edmond Fréme, francoski raziskovalec, je skušal ustvariti suho fluorhoridno kislino, da bi se izognil strupenosti vodikovega fluorida z zakistvim kalijevega bifluorida (KHF2), Vendar med elektrolizo ni bilo prevodnosti električnega toka.
Izolacija
Leta 1860 je poskusil angleški kemik George Gore. Vendar je prišlo do eksplozije z nasilnim rekombiranjem vodika s fluoridom. Gore je eksplozijo pripisal puščanju kisika.
Leta 1886 je francoski kemik Henri Moisson prvič uspel izolirati fluorid. Prej je bilo Moissonovo delo štirikrat prekinjeno zaradi hude zastrupitve z vodikovim fluoridom, medtem ko je poskušal izolacijo elementa.
Moisson je bil študent Frony in je temeljil na svojih poskusih za izolacijo fluorida. Moisson, ki se uporablja pri elektrolizi. Nastala raztopina LED električna energija in fluorirani plin, nakopičen v anodi; to je v pozitivno obremenjeni elektrodi.
Moisson je uporabil opremo za korozijo, v kateri so bile elektrode izdelane iz platine in iridijeve zlitine. V elektrolizi je uporabil platinasto posodo in ohladil elektrolitsko raztopino pri temperaturi -23 ° F (-31 ° C).
Končno je 26. junija 1886 Henri Moisson uspel izolirati fluorid, delo, ki mu je omogočilo osvojitev Nobelove nagrade leta 1906.
Zanimanje za fluorid
Nekaj časa je bilo izgubljeno zanimanje za preiskavo s fluoridom. Vendar pa razvoj projekta Manhattan za proizvodnjo atomske bombe.
Ameriško podjetje DuPont se je med letoma 1930 in 1940 razvil fluorirane izdelke, kot so klorofluorokarbonate (Freon-12), ki se uporabljajo kot hladilna sredstva; in polithetrafluoroetilen plastika, ki je najbolje znana z imenom teflon. To je povzročilo povečanje proizvodnje in porabe fluora.
Leta 1986 je na konferenci za stoletje izolacije fluora ameriški kemik Karl ali. Christe je predstavil kemijsko metodo za pripravo fluorida z reakcijo med K2Mnf6 in SBF5.
Vam lahko služi: polivinilni alkoholFizikalne in kemijske lastnosti
Videz
Fluor je bledo rumen plin. V tekočem stanju je svetlo rumena. Medtem je trdna snov lahko neprozorna (alfa) ali prozorna (beta).
Atomsko število (z)
9.
Atomska teža
18.998 u.
Tališče
-219,67 ° C.
Vrelišče
-188,11 ° C.
Gostota
Pri sobni temperaturi: 1.696 g/l.
Na tališču (tekočina): 1,505 g/ml.
Toplota za uparjanje
6,51 kJ/mol.
Molarna kalorična sposobnost
31 j/(mol · k).
Parni tlak
Pri temperaturi 58 K ima 986,92 atm parni tlak.
Toplotna prevodnost
0,0277 w/(m · k)
Magnetni vrstni red
Diamagnet
Vonj
Začinjen in prodorni značilen vonj, zaznaven tudi pri 20 ppb.
Oksidacijske številke
-1, kar ustreza fluoridnemu anionu, f-.
Ionizacijska energija
-Prvi: 1.681 kJ/mol
-Drugi: 3.374 kJ/mol
-Tretjič: 6.147 kJ/mol
Elektronegativnost
3.98 na lestvici Pauling.
To je kemični element z največjimi elektronegativnosti; to pomeni, da ima visoko afiniteto do elektronov atomov, s katerimi je povezan. Zaradi tega atomi fluora ustvarjajo velike dipolne trenutke v določenih območjih molekule.
Tudi njegova elektronegativnost ima še en učinek: atomi, povezani z njim, izgubijo toliko elektronske gostote, da začnejo pridobiti pozitivno obremenitev; To je pozitivna oksidacijska številka. Več atomov fluora v spojini bo imel osrednji atom bolj pozitivno oksidacijsko število.
Na primer v2 Kisik ima oksidacijsko število +2 (ali2+F2-); V UF6, Uran ima oksidacijsko število +6 (u6+F6-); Enako velja za žveplo v SF6 (S6+F6-); In končno je AGF2, kjer ima srebro celo oksidacijsko število +2, v njem nenavadno.
Zato elementi uspejo sodelovati s svojimi najbolj pozitivnimi oksidacijskimi številkami, ko tvorijo spojine s fluoridom.
Oksidacijsko sredstvo
Fluor je najmočnejši oksidacijski element, zato nobena snov ni sposobna oksidacije; In zaradi tega ni svoboden po naravi.
Reaktivnost
Fluor se lahko kombinira z vsemi drugimi elementi, razen s helijem, neonom in argonom. Prav tako ne napada sladkega jekla ali bakra pri normalnih temperaturah. Nasilno reagirajte z organskimi materiali, kot so guma, les in tkanina.
Fluorid lahko reagira s plemenitim plinskim ksenonom, da tvori močan difluoruro oksidant ksenona, xef2. Prav tako reagira z vodikom, da tvori halogenid, vodikov fluorid, HF. Vodikov fluorid se raztopi v vodi, da nastane znamenito fluorhorhorhorhorhorovo kislino (jesti steklo).
Kislost hidracijskih kislin, razvrščena po naraščajočem vrstnem redu, je:
Hf < HCl < HBr < HI
Dušikova kislina reagira s fluoridom, da tvori floorirani nitrat, fnO3. Medtem klorovodična kislina močno reagira s fluoridom, da tvori hf, od2 in CLF3.
Elektronska struktura in konfiguracija

Diatomska molekula
 Molekula fluorida, prikazana z modelom polnjenja prostora. Vir: Gabriel Bolívar.
Molekula fluorida, prikazana z modelom polnjenja prostora. Vir: Gabriel Bolívar. Atom fluora v bazalnem stanju ima sedem elektronov Valencije, ki sta v orbitali 2s in 2p v skladu z elektronsko konfiguracijo:
[On] 2s2 2 p5
Teorija povezav Valencia (TEV) določa, da sta dva atoma fluora, F, kovalentno povezana, da bi lahko dokončala svoj oktet v Valenciji.
To se hitro pojavi, ker komajda primanjkuje elektrona, da bi postal izolektronski do plemenitega neonskega plina; In njeni atomi so zelo majhni, z zelo močno učinkovito jedrsko obremenitvijo, ki zlahka zahteva elektrone okolja.
Molekula f2 (Vrhunska slika) ima preprosto kovalentno povezavo, F-F. Kljub svoji stabilnosti v primerjavi s prostimi atomi F je izjemno reaktivna molekula; Homonuklearni, apolarni in željni elektronov. Zato fluorid, kot je F2, Je zelo strupena in nevarna vrsta.
Ker f2 Je apolarna, njene interakcije so odvisne od njegove molekularne mase in londonskih disperzijskih sil. V nekem trenutku se mora elektronski oblak okoli obeh atomov F deformirati in izvirati takojšen dipol, ki inducira drugega v sosednji molekuli; tako da so počasi in šibki.
Tekočina in trdna
Molekula f2 Je zelo majhen in se širi v prostoru z relativno hitrostjo. V svoji plinski fazi ima bledo rumeno barvo (ki jo je mogoče zamenjati z apno zeleno). Ko temperatura pade na -188 ° C, disperzijske sile postanejo učinkovitejše in naredijo molekule F2 Kohezija dovolj, da določi tekočino.
Tekoči fluor (prva slika) je videti še bolj rumen kot njegov plin. V njem so molekule f2 So bližje in v večji meri komunicirajo s svetlobo. Zanimivo je, da ko izkrivljeno kubično steklo nastane od fluora do -220 ° C, barva zbledi in ostane prozorna trdna.
Vam lahko služi: razvejani alkaniZdaj, ko so M molekule2 So tako blizu (vendar brez zaustavitve molekulskih vrtenj), zdi se, da njihovi elektroni zaslužijo nekaj stabilnosti, zato je njihov elektronski skok prevelik, da bi lahko svetloba celo sodelovala s steklom.
Kristalne faze
Ta kubični kristal ustreza β fazi (ni alotropna, ker ostaja enak F2). Ko temperatura pade še več, do -228 ° C, trden fluor trpi fazni prehod; Kubično steklo se spremeni v monokliniko, α faza:
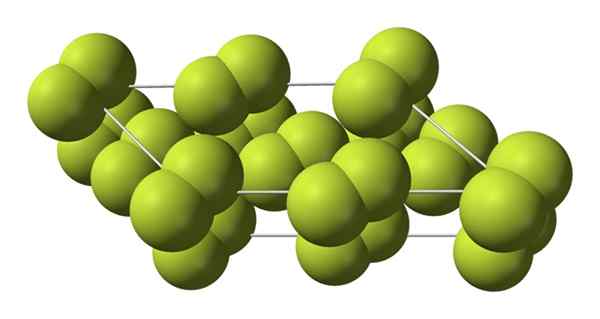
 Kristalna struktura alfa faze fluora. Vir: Benjah-BMM27 [javna domena].
Kristalna struktura alfa faze fluora. Vir: Benjah-BMM27 [javna domena]. Za razliko od β-f2, Α-f2 je neprozoren in trden. Mogoče zato, ker M molekule2 Nimajo več takšne svobode za vrtenje v svojih fiksnih položajih v monoklinskih kristalih; Kjer se v večji meri sporazumejo s svetlobo, vendar brez navdušenja nad svojimi elektroni (kar bi površno razložilo njihovo motnost).
Kristalna struktura α-F2 Težko je bilo preučiti s konvencionalnimi metodami difrakcije X -Rara. To je zato, ker je prehod iz faze β v α zelo eksotermičen; Torej je kristal praktično izkoristil, medtem ko je malo vplival na sevanje.
Približno petdeset let so preživeli pred nemškimi znanstveniki (Florian Kraus in sodelavci), popolnoma dešifrirali strukturo α-F2 z večjo natančnostjo zahvaljujoč nevtronskim difrakcijskim tehnikam.
Kje je in dobimo
Fluor zaseda 24. najpogostejše elemente v vesolju. Vendar je na Zemlji v maši 13vo element, s koncentracijo 950 ppm v zemeljski skorji in koncentracijo 1,3 ppm v morski vodi.
Tla imajo koncentracijo fluora med 150 in 400 ppm, na nekaterih tleh pa koncentracija lahko doseže 1.000 ppm. V atmosferskem zraku je prisoten v koncentraciji 0,6 ppb; Vendar se je registrirala v nekaterih mestih do 50 ppb.
Fluor dobimo predvsem iz treh mineralov: fluorita ali fluorosparja (kava2), Fluoroapatita [ca5(Po4)3F] in kreol (Na3Alf6).
Obdelava fluorita
Po zbiranju kamnin z mineralom fluorita so te podvržene primarnim in sekundarnim drobljenjem. S sekundarnim drobljenjem pridobivanja zelo majhnih drobcev kamnine.
Nato se drobci odpeljejo v mlin za zmanjšanje prahu. Voda in reagenti se dodajo, da tvorijo pasto, ki je nameščena v flotacijski rezervoar. Vbrizga se s pritiskom, da tvori mehurčke, zato se fluorit konča na vodni površini.
Silikati in karbonati so usedlina, medtem ko se fluorit zbira in vodi do sušenja pečic.
Ko fluorit dobimo, reagiramo z žveplovo kislino, da nastane vodikov fluorid:
Caf2 + H2SW4 => 2 HF +primer4
Elektroliza vodikovega fluorida
Pri proizvodnji fluorida se sledi nekaterim spremembam, z metodo, ki jo je Moisson uporabil leta 1886.
Izdelana je elektroliza mešanice staljenega kalijevega fluorida in fluohidrične kisline z molskim polmerom 1: 2,0 do 1: 2.2. Temperatura staljene soli je 70 - 130 ° C.
Katoda je sestavljena iz monetove ali jeklene zlitine, anoda. Proces proizvodnje fluora med elektrolizo je mogoče shematizirati na naslednji način:
2HF => H2 + F2
Voda se uporablja za hlajenje komore za elektrolizo, vendar mora biti temperatura nad tališčem elektrolita, da se prepreči strjevanje. V katodi se zbira vodik, ki nastane pri elektrolizi, medtem ko fluorid v anodi.
Izotopi
Fluorid ima 18 izotopov, ki so 19F edini stabilen izotop s 100% številčnostjo. On 18F ima pol življenja 109,77 minut in je radioaktivni izotop fluora z največjo polovico življenja. On 18F Uporablja se kot vir pozitrona.
Biološki papir
Presnovna aktivnost fluora pri sesalcih ali zgornjih rastlinah ni znana. Vendar nekatere morske rastline in gobice sintetizirajo monofluroacetat, strupeno spojino, ki uporablja kot zaščito, da se prepreči uničenje.
Tveganja
Prekomerna poraba fluora je bila povezana s fluorozo kosti pri odraslih in zobno fluorozo pri otrocih, pa tudi s spremembami v delovanju ledvic. Zaradi tega je ameriška javna zdravstvena služba (PHS) predlagala, da koncentracija fluorida v pitni vodi ne bi smela biti večja od 0,7 mg/L.
Medtem je ameriška agencija za zaščito za okolje (EPA) ugotovila, da koncentracija fluorida v pitni vodi ne bi smela biti večja od 4 mg/L, da bi se izognili skeletni fluorozi, pri kateri se fluorid kopiči v kosteh. To lahko povzroči oslabitev kosti in zlome.
Fluor je bil povezan s poškodbo paratiroidne žleze, z zmanjšanjem kalcija v kostnih strukturah in visokimi koncentracijami kalcija v plazmi.
Lahko vam služi: živa snov: koncept, značilnosti in primeriMed spremembami, ki jih pripisujejo presežnemu fluoru, so naslednje: zobna fluoroza, skeletna fluoroza in poškodba paratiroidne žleze.
Zobna fluoroza
Zobna fluoroza je predstavljena z majhnimi črtami ali motocikli v zobni sklenini. Otroci, mlajši od 6 let.
Skeletna fluoroza
Pri skeletni fluorozi lahko diagnosticiramo bolečino in poškodbe, pa tudi v sklepih. Kost se lahko strdi in izgubi elastičnost, kar poveča tveganje za zlome.
Prijave
Zobna pasta
 Nekatere anorganske soli fluorida se uporabljajo kot dodatek pri formulaciji zobnih past, ki so pokazali, da pomagajo zaščititi zobno sklenino. Vir: pxhere.
Nekatere anorganske soli fluorida se uporabljajo kot dodatek pri formulaciji zobnih past, ki so pokazali, da pomagajo zaščititi zobno sklenino. Vir: pxhere. Začnemo z odsekom uporabe fluorida z najbolj znanim: služiti kot sestavni del številnih zobnih past. To ni edina uporaba, kjer je mogoče videti kontrast med njegovo molekulo F2, izjemno strupeno in nevarno, in anion f-, kar je odvisno od njegovega okolja (čeprav včasih ne).
Ko jemo hrano, še posebej sladkarije, jih bakterije razgradijo s povečanjem kislosti naše sline. Potem je točka, ko je pH dovolj, da se razgradi in demineralizira zobno sklenino; Hidroksiapatit pride "navzdol".
Vendar v tem procesu ioni f- interakcijo s ca2+ tvoriti fluorapatitno matrico; bolj stabilen in trajen kot hidroksiapatit. Ali vsaj to je predlagani mehanizem za razlago delovanja fluoridnega aniona na zobeh. Verjetno je bolj zapleten in da obstaja hidroksiapatit-fluorapatit, odvisen od pH.
Ti anioni f- Na voljo so v zobnih papah v soli; kot je: NAF, SNF2 (Znani fluorid Stine) in Napof. Vendar koncentracija f- Mora biti nizka (manj kot 0,2%), saj sicer povzroča negativne učinke na telo.
Fluorizacija vode
Zelo podobno, kako so z zobnimi pastami dodali fluoridne soli v vire pitne vode za boj proti videzu kariesa pri tistih, ki ga pijejo. Koncentracija mora biti še vedno precej nižja (0,7 ppm). Vendar je ta praksa običajno nezaupljiva in sporna, kot je mogoče, karcinogeni učinki so pripisani.
Oksidacijsko sredstvo
Plin f2 Obnaša se kot zelo močno oksidacijsko sredstvo. Zaradi tega se številne spojine uredijo več kot kadar so izpostavljene kisiku in viru toplote. Zato je bil uporabljen v mešanicah raketnega goriva, v katerih lahko celo nadomestijo ozon.
Polimeri
Pri mnogih uporabi prispevki fluorida niso posledica F2 ali f-, Toda neposredno na svoje elektronegativne atome, ki so del organske spojine. Zato je v bistvu povezave C-F.
Glede na strukturo so polimeri ali vlakna s C-F vezi običajno hidrofobni, zato se ne zmočijo ali se upirajo napadu fluorhorične kisline; Ali še bolje, so lahko odlični električni izolatorji in uporabni materiali, s katerimi se izdelujejo predmeti, kot so cevi in sklepi. Teflon in Navion sta primera teh fluoriranih polimerov.
Farmacevti
Reaktivnost fluorida se imenuje njegova uporaba za sintezo več fluorinskih, organskih ali anorganskih spojin. Pri organskih, zlasti tistimi s farmakološkimi učinki, enega od njihovih heteroátomosov nadomestijo z atomi F poveča (pozitivno ali negativno) njegovo delovanje na njihov biološki cilj.
Zato je v farmacevtski industriji sprememba nekaterih zdravil vedno na mizi z dodajanjem atomov fluora.
Zelo podobno se pojavlja pri herbicidih in fungicidih. Fluor v njih lahko poveča njihovo delovanje in učinkovitost na žuželkah in škodljivcih gliv.
Steklena graviranje
Za snemanje tankih in občutljivih kosov teh materialov je bila uporabljena fluorhorična kislina zaradi agresivnosti s steklom in keramiko; Običajno namenjen proizvodnji računalniških mikrokomponentov ali za električne žarnice.
Obogatitev urana
Ena najpomembnejših uporabe osnovnega fluorida je pomagati obogatiti uran kot 235Ali. Da bi to naredili, se uranovo minerali raztopijo v fluorhorični kislini in proizvajajo UF4. Ta anorganski fluorid nato reagira s F2, Preoblikovati v UF6 (235Few6 in 238Few6).
Pozneje in s plinskim centrifugiranjem 235Few6 Loči se od 238Few6 nato pa oksidirano in shranjeno kot jedrsko gorivo.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Krämer Katrina. (2019). Struktura zamrznjenega fluora je bila po 50 letih ponovno ovijena. Kraljevsko društvo za kemijo. Okrevano od: ChemistryWorld.com
- Wikipedija. (2019). Fluor. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2019). Fluor. Baza podatkov Pubchem. Cid = 24524. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Doktor. Doug Stewart. (2019). Dejstva fluora. Kemikool. Okrevano od: Chemicool.com
- Batul Nafisa Baxamusa. (21. februar 2018). Presenetljivo pogosta uporaba zelo reaktivnega fluora. Okrevano od: ScienceStruck.com
- Paola Opazo Sáez. (4. februar 2019). Fluorid v zobni pasti: ali je dober ali slab za zdravje? Okrevano od: nacionfarma.com
- Karl Christe & Stefan Schneider. (8. maj 2019). Fluor: kemični element. Encyclopædia Britannica. Okrevano od: Britannica.com
- Lentech b.V. (2019). Tabela obdobja: kisik. Okrevano od: Lentech.com
- Gagnon Steve. (s.F.). Fluor elementa. Jefferson Lab. Okrevano od: izobraževanje.Jlab.org
- Ameriška skupina za medicinsko in uredniško vsebino American Cancer Society. (28. julij 2015). Fluoriranje vode in tveganje za raka. Okrevano od: rak.org

