Kalijev nitrat (KNO3)
- 3379
- 87
- Ricky Dach
Kaj je kalijev nitrat?
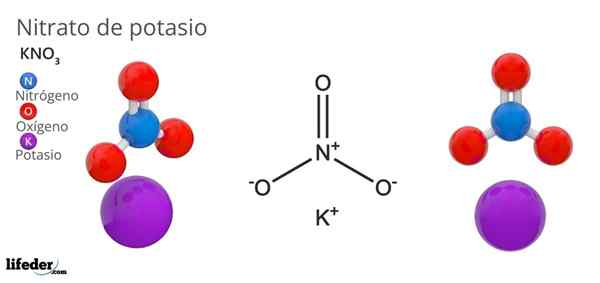
On kalijev nitrat To je trinarna sol, sestavljena iz kalijeve, alkalne kovine in nitratnega oksoaniona. Njegova kemična formula je kno3, Kar pomeni, da za vsak k ion+, Ni iona3-- interakcijo s tem. Zato je ionska sol in predstavlja enega od alkalnih nitratov (lino3, Starejši brat3, Rbno3…).
Kno3 To je močno oksidacijsko sredstvo zaradi prisotnosti nitratnega aniona. To pomeni, da deluje kot rezerva trdnih nitratnih ionov, za razliko od drugih zelo topnih soli v vodi ali zelo higroskopskih. Številne lastnosti in uporabe te spojine so posledica nitratnega aniona, ne pa kalijevega kationa.
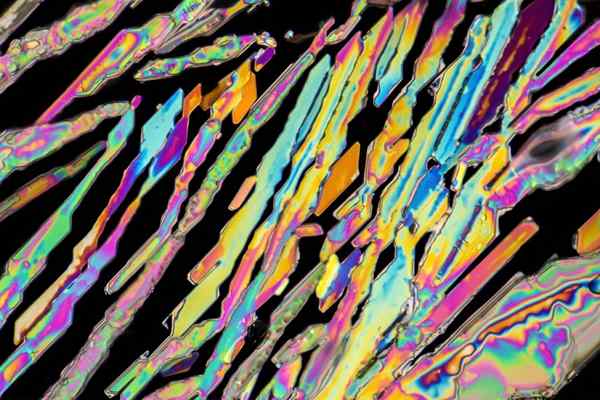 Kristali kalijevega nitrata
Kristali kalijevega nitrata Na zgornji sliki je ponazorjeno nekaj kristalov KNO3 z oblikami igle. Naravni vir kno3 je solini, znan kot imena Solini tudi Balon, v angleščini. Ta element je znan tudi kot mineral Potassa nitrat ali nitro.
Nahaja se na sušnih ali puščavskih območjih, pa tudi odtok kavernoznih sten. Še en pomemben vir Kno3 Guano, iztrebki živali, naseljujejo suha okolja.
Kemična struktura kalijevega nitrata
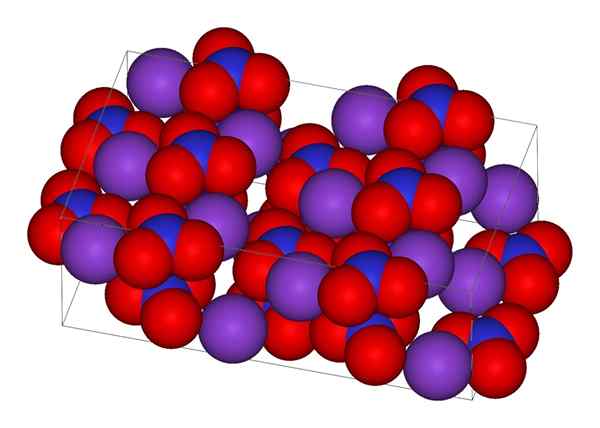 Kristalna struktura kalijevega nitrata
Kristalna struktura kalijevega nitrata Na zgornji sliki je predstavljena kristalna struktura KNO3. Vijolične kroglice ustrezajo k ionom+, Medtem ko sta rdeča in modra atoma kisika in dušika. Kristalna struktura je ortorrambična pri sobni temperaturi.
Geometrija Nion št3- To je trigonalna ravnina, z atomi kisika v točki trikotnika in atomom dušika v njegovem središču. Predstavlja pozitivno formalno obremenitev v dušikovem atomu in dve negativni formalni obremenitvi v dveh atomih kisika (1-2 = (-1)).
Vam lahko služi: preprost mikroskopTi dve negativni naboji št3- Presežejo se med tremi atomi kisika in vedno ohranjajo pozitivno obremenitev v dušiku. Zaradi zgoraj navedenega k ioni-+ kristala se izogibajo biti tik nad ali pod dušikom anionov3-.
Pravzaprav slika prikazuje, kako k ioni+ Obkroženi so s kisikovimi atomi, rdečimi kroglami. Za zaključek so te interakcije odgovorne za kristalne ureditve.
Druge kristalne faze
Spremenljivke, kot sta tlak in temperatura, lahko spremenijo te ureditve in povzročijo različne strukturne faze za KNO3 (Faze I, II in III). Na primer, faza II je slika, medtem ko se faza I (s trigonalno kristalno strukturo) tvori, ko se kristali segrejejo do 129 ° C.
Faza III je prehodna trdna snov, ki jo dobimo s hlajenjem faze I, nekatere študije pa so pokazale, da ima nekatere pomembne fizikalne lastnosti, kot je feroelektričnost. V tej fazi kristal tvori kalijeve plasti in nitrati, morda občutljive na elektrostatične odbojnosti med ioni.
V plasteh faze III anioni št3- Izgubijo malo svoje planarnosti (trikotnik krivulje nekoliko), da omogočijo to ureditev, ki pred kakršno koli mehansko motnjo postane struktura faze II.
Uporaba/uporabe kalijevega nitrata
Sol je zelo pomembna, saj se uporablja v številnih človeških dejavnostih, ki se kažejo v industriji, kmetijstvu, hrani itd. Te uporabe vključujejo naslednje:
- Ohranjanje hrane, še posebej meso. Kljub sumu, da se vmeša v oblikovanje nitrozamina (rakotvornega sredstva), se še vedno uporablja pri Charcuterieju.
- Gnojilo, ker kalijev nitrat zagotavlja dve od treh rastlin makronutrienta: dušik in kalij. Skupaj s fosforjem je ta element potreben za razvoj rastlin. To pomeni, da je pomembna in obvladljiva rezerva teh hranil.
- Pospeši izgorevanje in lahko proizvaja eksplozije, če je gorljiv material obsežen ali če je fino razdeljen (večja površina, večja reaktivnost). Poleg tega je ena glavnih sestavnih delov smodnika.
- Olajša odstranitev dotikov visokih dreves. Nitrate dobavlja dušik, potreben za glive, da uničijo les panjev.
- Posega v zmanjšanje občutljivosti zob z vgradnjo v denfiric.
- Vmešava kot hipotenzotor pri regulaciji krvnega tlaka pri ljudeh. Ta učinek bi bil dodeljen ali medsebojno povezan s spremembo izločanja natrija. Priporočeni odmerek pri zdravljenju je 40-80 mEq/dan kalija. V zvezi s tem je poudarjeno, da bi imel kalijev nitrat diuretično delovanje.
Sinteza
Večina nitrata se proizvaja v rudnikih puščav v Čilu. Lahko ga sintetizira več reakcij:
Nh4Ne3 (ac) +koh (ac) => nh3 (Ac) +kno3 (Ac)+h2Ali (l)
Kalijev nitrat tudi nevtralizira dušikovo kislino s kalijevim hidroksidom v zelo eksotermični reakciji.
Koh (ac) +hno3(conc) => kno3 (Ac) +h2Ali (l)
V industrijskem obsegu se kalijev nitrat proizvaja z reakcijo z dvojnim premikom.
Starejši brat3 (AC) +KCl (AC) => NACl (AC) +KNO3 (AC)
Glavni vir KCL je iz minerala Silvina in ne drugih mineralov, kot sta karnalit ali kainit, ki so sestavljeni tudi iz ionskega magnezija.
Fizikalne in kemijske lastnosti
Kalijev nitrat v trdnem stanju je predstavljen kot bel ali v obliki kristalov ortorumbije pri okolici in trigonalni pri 129 ° C. Ima molekulsko maso 101.1032 g/mol, je stranišče in ima okus slane hektarja.
To je zelo topna spojina v vodi (316-320 g/liter vode, pri 20 ° C) zaradi svoje ionske narave in enostavnosti molekul vode za reševanje K iona K+.
Njegova gostota je 2,1 g/cm3 pri 25 ° C. To pomeni, da je približno dvakrat gosta kot voda.
Njegove talilne točke (334 ° C) in vrenje (400 ° C) kažeta na ionske vezi med k+ in ne3-. Vendar so v primerjavi z drugimi soli nizki, ker je kristalna retikularna energija nižja za monovalentne ione (to je z obremenitvami ± 1) in tudi nimajo zelo podobnih velikosti.
Vam lahko služi: pH indikatorjiRazpade pri temperaturi blizu vrelišča (400 ° C), da nastane kalijev in molekularni kisik:
Kno3(S) => kno2(s) + oz2(g)
Reference
- Pubchem. (2018). Kalijev nitrat. Okrevano od PubChema.NCBI.NLM.Nik.Gov
- Krist dejanje. (2009). Rast in enokristalno izpopolnjevanje kalijevega nitrata faze III, kno3. B65, 659-663.
- Marni Wolfe. (3. oktober 2017). Tveganja kalijevega nitrata. Livestrong si je opomogel.com
- Amethyst Galleries, Inc. (1995–2014). Mineralni niter. Galerije so bile obnovljene.com