Svinčene strukture nitrata, lastnosti, pridobivanje, uporabe

- 668
- 27
- Cary Goyette
On svinčeno nitrat o svinčni nitrat (II) je anorganska spojina, ki jo tvorijo svinčeni elementi (PB), dušik (N) in kisik (O). Svinec najdemo kot ion pb2+ In dušik in kisik tvorita nitratni ion3-.
Njegova kemična formula je PB (ne3)2. Je bela kristalna trdna trdna zelo topna v vodi, kjer tvori PB ione2+ in ne3-. Znana je tudi kot Plumbose nitrat, ker je svinca v najnižjem oksidacijskem stanju.
 Trden svinčni nitrat. Ondřej mangl / pub domena. Vir: Wikimedia Commons.
Trden svinčni nitrat. Ondřej mangl / pub domena. Vir: Wikimedia Commons. Ima močno oksidacijske lastnosti, zato se uporablja v aplikacijah, kjer je potrebna ta značilnost, na primer pri pripravi različnih organskih spojin in kot laboratorijski reagent.
V preteklosti so ga pogosto uporabljali za pripravo barv, ki temeljijo na svincu, kjer je deloval tudi kot fiksir barv v tkivih. Ta prijava je bila opuščena zaradi strupenosti svinca.
V metalurški industriji se je uporabljal na različne načine, v zadnjem času pa je bilo ugotovljeno, da se njegova uporabnost skupaj z drugimi spojinami, materiali z visoko absorpcijsko zmogljivostjo in preoblikovanje tega v električni energiji.
Vendar je nevarna snov, ker lahko daje prednost generaciji požara. Prav tako je strupen za človeka, živali in rastline, zato ga v okolju nikoli ne bi smeli zavreči.
[TOC]
Struktura
To je ionska spojina, ki jo tvori PB kation2+ in dva aniona št3-. V nitratnem anion kisiku se simetrično razporedi okoli dušika in izmenično dvojno vez s tem.
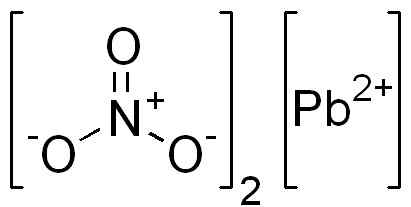 Struktura PB (št3)2. Edgar181 / pub domena. Vir: Wikimedia Commons.
Struktura PB (št3)2. Edgar181 / pub domena. Vir: Wikimedia Commons. 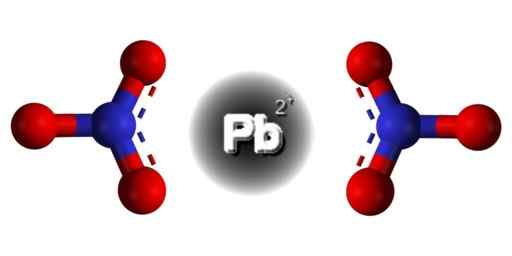 Prostorska struktura PB (št3)2. Siva = svinec; modra = dušik; Rdeča = kisik. Claudio pistilli/cc by-s (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons.
Prostorska struktura PB (št3)2. Siva = svinec; modra = dušik; Rdeča = kisik. Claudio pistilli/cc by-s (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons. Vodja v tej spojini ima naslednjo elektronsko konfiguracijo:
[Xe] 4F14 5d10 6s2 6str0, kjer je opaziti, da je izgubil 2 elektrona zadnje plasti.
Vam lahko služi: kaj je najbolj elektronegativni element in zakaj?Nomenklatura
- Svinčeno nitrat
- Svinčni nitrat (ii)
- Pluboso nitrat
- Svinčeno dinitrat
Lastnosti
Fizično stanje
Bela ali brezbarvna kristalna trdna. Kubični kristali.
Molekularna teža
331 g/mol
Tališče
470 ° C. Po nekaterih virih se razgradi pri tej temperaturi.
Gostota
4,53 g/cm3
Topnost
Zelo topno v vodi: 59,7 g/100 ml vode pri 25 ° C. Rahlo topen v etanolu. Netopna v dušikovi kislini (hno3) koncentrirano.
ph
Vodna raztopina z 20% PB (št3)2 Ima pH 3,0-4.0.
Kemične lastnosti
Je oksidacijsko sredstvo. Silovito reagira z gorljivimi materiali in reduktorji.
Ni gorivo, ampak lahko pospeši kurjenje materialov, ki so. Če segrejete do njegove razgradnje, oddaja strupene pline dušikovega oksida:
2 pb (št3)2 + toplota → 2 PBO + 4 št2↑ + o2↑
Pri raztapljanju v vodi je ionizirano:
PB (št3)2 + H2O → pb2+ + 2 Ne3-
Pridobivanje
Pripravimo ga lahko z reakcijo kovinskega svinca, svinčevega monoksida (PBO) ali svinčevega karbonata3 Z dušikovo kislino. Za preprečevanje osnovnih nitratov je priročno uporabiti kislinski presežek.
PBO + 2 HNO3 (koncentrirano) → PB (št3)2↓+ h2Tudi
Prijave
V organskem
Njegova oksidacijska sposobnost ima pri pripravi različnih spojin.
Uporablja se za sintezo calixarenosa, ki so organske spojine, katerih molekula ima obliko košare, ki omogoča nastanitev drugih snovi, odvisno od uporabe.
Služi za pridobivanje izotiocinatov (R-CS), ki se začnejo iz aminov (R-NH2).
Uporablja se v industrijskem obsegu za pripravo benzaldehida, ki oksidira benchilo klorid. Služi tudi kot katalizator za esterifikacijo organskih spojin, na primer pri pridobivanju poliestranov.
V kemični analizi
Uporablja se kot reagent pri določanju aluminija in svinca v mineralih in kamninah.
V obarvanju tekstilnih vlaken
Nekatera kromirana barvila zahtevajo uporabo PB (ne3)2 pridobiti. Na primer, da obarva bombažno rumeno.
Vam lahko služi: enakovredna težaNato se za tvorbo svinčevega kromata uporabi razredčena raztopina natrijevega dikromata (PBCRO4) To je rumen pigment.
 Pred časom so bile rumene tkanine obarvane s pigmenti, katerih izhodišče je bilo PB (ne3)2. To ne stori s toksičnostjo svinca. Avtor: 3D Animation Production Company. Vir: Pixabay.
Pred časom so bile rumene tkanine obarvane s pigmenti, katerih izhodišče je bilo PB (ne3)2. To ne stori s toksičnostjo svinca. Avtor: 3D Animation Production Company. Vir: Pixabay. Vendar pa so danes svinčeni pigmenti za njihovo strupenost prenehali.
Prav tako deluje kot mordant, da popravi barvila med barvo ali tiskanjem drugih vrst vlaknin.
V Medini Veterinary
Prej so ga uporabljali kot kavstično sredstvo pri zdravljenju kanalov ali gangrene pri konjih.
V kovinski industriji
Svinčni nitrat se uporablja pri elektrolitskem rafiniranju svinca, kot sredstvo, ki daje prednost flotaciji pri odstranjevanju titana nekaterih gline, omogoča obnovo plemenitih kovin cianidnih raztopin in se uporablja v elektrodi PBO2 pri nikljevih anodah.
V sončnih celicah
Uporablja se v obliki vodne raztopine za izdelavo sončnih celic na osnovi Perovskite, minerala iz titanovega oksida.
Sintetizirani material je organometalna ali pervskita svinčevega jodida, ki je pritegnila pozornost raziskovalcev, saj ima visoko absorpcijsko sposobnost svetlobe in veliko difuzijsko dolžino nosilcev obremenitve.
Te lastnosti so odličen kandidat za fotonapetostne naprave, to je, da svetlobo spremenijo v električni tok.
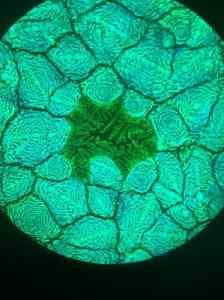 Mikrofotografija strukture UNAVSKITA svinčevega halogenida, odvzetega s fluorescentnim mikroskopom. Furava/cc by (https: // creativeCommons.Org/licence/by/4.0. Vir: Wikimedia Commons.
Mikrofotografija strukture UNAVSKITA svinčevega halogenida, odvzetega s fluorescentnim mikroskopom. Furava/cc by (https: // creativeCommons.Org/licence/by/4.0. Vir: Wikimedia Commons. Druge aplikacije
On (Pbno3)2 Uporablja se tudi:
- V proizvodnji tekem so določeni eksplozivi in pirotehnični materiali,
- V fotografiji kot senzibilizirajočem sredstvo za pokrivanje papirja v fototermografiji,
- V tekstilni industriji za izboljšanje rajona in stabilizacijo najlona,
- V izločitvi glodalcev.
 Svinčevi nitrat je bil uporabljen za proizvodnjo ognjemeta ali pirotehničnega materiala. Avtor: brezplačni goos. Vir: Pixabay.
Svinčevi nitrat je bil uporabljen za proizvodnjo ognjemeta ali pirotehničnega materiala. Avtor: brezplačni goos. Vir: Pixabay. Tveganja
Požar in eksplozija
Čeprav ne gre za gorivno spojino, če je izpostavljena ognju ali toploti, lahko eksplodira, ustvari strupene dušikove okside.
Ker je močno oksidacijsko sredstvo, obstaja nevarnost, da nastane požar, če pride v stik z organskimi materiali.
Do zdravja
Proizvaja draženje oči, dihalne in prebavne trakte. Je strupen z vdihavanjem in zaužitjem. Najpogostejši simptomi zastrupitve s to spojino so prebavila, kolike, zaprtje in šibkost, ki lahko med drugim postanejo paraliza nekaterih mišic.
Njegovo zaužitje lahko povzroči tudi bolečine, krče, depresijo, komo in smrt.
Za naravno okolje
To je strupen za vodne in kopenske organizme, poleg tega pa so njihove škode vztrajne in bioakumule pri živih bitjih, zato se šteje.
Če se po naključju razlije v vodi, ga je treba nevtralizirati s kalcijevim oksidom (CAO), kalcijevim karbonatom (CACO3) ali natrijev bikarbonat (Nahco3).
Potrjeno je, da je karcinogen za živali in morda za človeka.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Svinec (ii) nitrat. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- HSIH, t.In. et al. (2015). Učinkovita sončna celična celica, izdelana z vodnim predhodnikom svinčevega nitrata. Chem Commun (sprememba). 2015 september 4; 51 (68): 13294-7. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Vratny, f. in Gugliotta, f. (1963). Tematska razgradnja svinčevega nitrata. J. Inorg. Nucl. Kem., 1963, Vol. 25, str. 1129-1132. Okrevano od Scientirect.com.
- Chakraborty, j.N. (2014). Barvanje z mineralnimi barvami. V skladih in praksah v barvni testili. Okrevano od Scientirect.com.
- Kumari, h. in Atwood, J. (2017). Kalixareni v trdnem stanju. V referenčnem modulaciji v kemiji, molekulskih znanosti in kemijskega inženirstva. Okrevano od Scientirect.com.
- Jeffery, str.G. in Hutchison, D. (1981). Aluminij. V kemijskih metodah analize kamnin (tretja izdaja). Okrevano od Scientirect.com
- Sandler, s.R. in karo, w. (1992). Cianate, izocianate, tiocianate in izotiocianate. V izvorni knjigi naprednih organskih laboratorijskih pripravkov. Okrevano od Scientirect.com.
- Smith, str.W.G. et al. (1969). Aromatične halogenske spojine. V aromatični kemiji. Okrevano od Scientirect.com.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Svinec, d.R. (Urednik) (2003). Priročnik za kemijo in fiziko CRC. 85th CRC Press.
- Fundacija Wikimedia (2020). Svinec (ii) nitrat. Pridobljeno iz.Wikipedija.org.
- Shinde, d.V. et al. (2017). Izboljšana učinkovita in stabilnost vodne svinčeve-nitratne organometalllične perovskitne sončne celice. ACS Appl. Mater. Vmesniki 2017, 9, 14023-14030. Okrevani iz lokalov.Acs.org.
- « Lastnosti, vrste, vrste, aplikacije fenolov ali fenolnih spojin
- Svinčeno strukturo acetata, lastnosti, pridobivanje, uporabe »

