Kalcijev nitrat (CA (NO3) 2)

- 3389
- 850
- Stuart Armstrong
On kalcijev nitrat Gre za terciarno anorgansko sol, katere kemična formula je CA (ne3)2. Iz njegove formule je znano, da je njegova trdna snov sestavljena iz Ca ionov2+ in ne3- V deležu 1: 2. Zato je spojina čisto ionske narave.
Ena od njegovih lastnosti je njegov oksidacijski značaj, po nitratnem anionu. To ni gorivo, torej ne gori pri visokih temperaturah. Ker je ne goji, predstavlja varno trdno snov, ki ga lahko manipulira brez večje oskrbe; Vendar lahko pospeši vžig gorljivih materialov.
 Trden kalcijev nitrat. Vir: Ondřej Mangl [Public Domain], iz Wikimedia Commons
Trden kalcijev nitrat. Vir: Ondřej Mangl [Public Domain], iz Wikimedia Commons Njegov videz je sestavljen iz zrnate trdne snovi, ki predstavlja svetlo belo ali sivo barvo (vrhunska slika). Lahko je brezvodni ali tetrahidrat, CA (ne3)2· 4H2Tudi. Je zelo topen v vodi, metanolu in acetonu.
Kalcijev nitrat se pogosto uporablja kot gnojilo, saj se zlahka premika v vlažnih tleh in ga hitro absorbirajo korenine rastlin. Oskrbuje dva pomembna elementa za prehrano in rast rastlin: dušik in kalcij.
Nitrogen je eden od treh bistvenih elementov za razvoj rastlin (N, P in K), je bistvenega pomena pri sintezi beljakovin. Medtem je za vzdrževanje strukture celične stene rastlin potreben kalcij. Zaradi tega CA (ne3)2 Vrtovi so zelo usojeni.
Po drugi strani pa ima ta sol strupena dejanja, zlasti z neposrednim stikom s kožo in očmi, pa tudi vdihava njegov prah. Poleg tega ga je mogoče razčleniti s segrevanjem.
Struktura kalcijevega nitrata
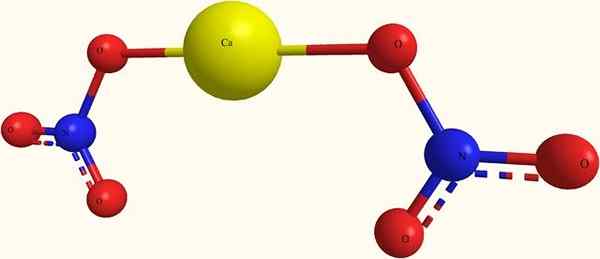 Ioni kalcijevega nitrata. Vir: ja.Hardnox pri Ru.Wikipedia [Public Domain], iz Wikimedia Commons
Ioni kalcijevega nitrata. Vir: ja.Hardnox pri Ru.Wikipedia [Public Domain], iz Wikimedia Commons Na zgornji sliki je struktura CA (ne3)2 V modelu sfer in palic. Tu pa obstaja napaka: predpostavlja se obstoj CA-O kovalentnih vezi, ki nasprotuje njegovemu ionskemu značaju. Pojasnite, da so interakcije resnično elektrostatične vrste.
Kation ca2+ Obkrožen je z dvema anionoma3- Glede na svoje deleže v kozarcu. Dušik v obliki nitrata v kristalni strukturi prevladuje.
Ioni so razvrščeni tako, da vzpostavijo konfiguracijo, katere minimalni izraz je enotna celica; ki je za brezvodno sol kubično. To pomeni, da se kocka, ki vsebujejo delež 1: 2 za te ione, reproducirano celotno kozarec.
Vam lahko služi: kositer: struktura, lastnosti, pridobivanje, uporabePo drugi strani pa tetrahidratna sol, CA (ne3)2· 4H2Ali ima štiri molekule vode za vsak komplet3- AC2+ Ne3-. To spreminja kristalno strukturo in jo deformira v enotni monoklinski celici.
Zato so kristali za obe soli, brezvodni in tetrahidrat različni; Razlike, ki jih je mogoče določiti v njihovih fizikalnih lastnostih, na primer fuzijske točke.
Fizikalne in kemijske lastnosti
Kemična imena
-Kalcijev nitrat
-Kalcijev dinitrat
-Nitrocalcita
-Norveški Salitre in Limesaltpetro.
Molekularna formula
Izliv3)2 ali lahko2Tudi6
Molekularna teža
Anhidro 164.088 g/mol in tetrahidrat 236,15 g/mol. Opazite učinek vode na molekulsko maso in je ni mogoče zaničevati, ko je težaven.
Fizični videz
Trdna ali svetlo siva zrnca. Kubični beli kristali ali okusna zrnca; to pomeni, da vlago absorbirajo do te mere, da raztopijo produkt svoje visoke topnosti.
Vrelišče
Brezvodna oblika se razgradi s segrevanjem pri temperaturi, ki preprečuje določitev njegove vrelišča; Medtem ko ima oblika tetrahidratne soli vrelišče 132 ° C (270 ° F, 405 K).
Tališče
-Anhidra Oblika: 561 ° C do 760 mmHg (1042 ° F, 834 K).
-Oblika tetrahidrata: 42,7 ° C (109 ° F, 316 K).
To kaže, kako molekule vode motijo elektrostatične interakcije med CA2+ in ne3- znotraj kristalov; In posledično se trdna snov topi pri precej nižji temperaturi.
Topnost vode
-Anhidra oblika: 1212 g/l pri 20 ° C.
-Oblika tetrahidrata: 1290 g/l pri 20 ° C.
Voda v kristalih komaj poveča topnost soli.
Topnost v organskih topilih
-V etanolu 51,42 g/100 g pri 20 ° C.
-V metanolu 134 g/100 g pri 10 ° C.
-V acetonu 168 g/100 g pri 20 ° C.
Kislost (PKA)
6.0
Gostota
2,5 g/cm3 pri 25 ° C (tetrahidrat).
Razgradnja
Kadar se kalcijev nitrat segreje do žarišča, se razgradi v kalcijev oksid, dušikov oksid in kisik.
Reaktivni profil
To je močno oksidacijsko sredstvo, vendar ni gorivo. Pospeši vžig gorljivih materialov. Delitev kalcijevega nitrata na drobne delce olajša njegovo eksplozijo, ko je spojina izpostavljena dolgotrajnemu ognju.
Vam lahko služi: ne -perozne zlitine: struktura, lastnosti, uporabe, primeriMešanice z alkilnimi estri postanejo eksplozivne s povzročanjem estrov alkil nitrata. Kombinacija kalcijevega nitrata s fosforjem, kositrnim kloridom (II) ali drugim reducirajočim sredstvom lahko reagira eksplozivno.
Prijave
Kmetijstvo
Uporablja se v pridelkih kot vir dušika in kalcija. Kalcijev nitrat je v vodi zelo topen in ga zlahka absorbirajo korenine rastlin. Poleg tega ne zakisa tal, ker njihovi ioni ne morejo bistveno hidrolizirati.
Njeni mešanici se je treba izogibati z gnojili, ki vsebujejo fosfor ali sulfat, da se izognete tvorbi netopnih soli. Po vaši higroskopičnosti ga je treba shraniti v suhem in svežem okolju.
Njegova uporaba ima prednost pred uporabo amonijevega nitrata kot gnojila. Medtem ko slednja spojina prinaša rastline dušik, posega v absorpcijo kalcija, kar lahko povzroči pomanjkanje kalcija v rastlinah.
Kalcij prispeva k vzdrževanju strukture celične stene rastline. V prisotnosti pomanjkanja kalcija tkiva v tvorbi rastlin, kot so konice korenin, mladi listi in konice izbruhov, pogosto kažejo izkrivljeno rast.
Zmanjšanje amonija
Kalcijev nitrat zmanjšuje kopičenje hlapnih maščobnih kislin in fenolnih, fitotoksičnih spojin, ki se kopičijo z razgradnjo odpadkov soje.
Poleg tega obstaja trend kalcijevega nitrata za zmanjšanje koncentracije amonija v tleh, kar povečuje zmogljivost dušenja vodika.
Beton
Kalcijev nitrat se uporablja za zmanjšanje časa nastavitve betona. To nastane s pomočjo nastajanja kalcijevega hidroksida, morda z dvojnim odmenjem reakcije.
Poleg tega kalcijev nitrat sproži nastajanje železove hidroksidne spojine, katere zaščitno delovanje betona zmanjšuje njegovo korozijo. To pomeni, da lahko sedanjo železo reagira z osnovnimi komponentami betona, kot je sam kalcijev hidroksid.
Kalcijev nitrat zmanjšuje čas nastavitve in odpornost betona, ki so mu bili dodani vulkanski pepel. Za preučevanje učinka agregata kalcijevega nitrata na beton, povečane koncentracije kalcijevega nitrata, so bile uporabljene med 2% in 10%.
Lahko vam služi: molarna frakcija: kako je izračunana, primeri, vajeOpazili so večje zmanjšanje nastavitvenega časa, pa tudi povečanje odpornosti na beton, saj se je koncentracija kalcijevega nitrata povečala na 10%.
Čiščenje odplak ali odpadkov
Kalcijev nitrat se uporablja za zmanjšanje slabih vonj po odplakah z zmanjšanjem vodikovega sulfida. Poleg tega se organske snovi, ki ustvarjajo anaerobne pogoje, zaustavijo preživetje številnih bioloških vrst.
Priprava hladnega stiskanja
Tetrahidratni kalcijev nitrat je endotermična spojina, torej lahko absorbira toploto iz okolja, ki ga obdaja. To povzroči hlajenje trupel, ki pridejo v stik s posodami, ki ga vsebujejo.
Obkladi povišajo temperaturo in da jih regenerirajo, dovolj je, da jih postavite v zamrzovalnik
Koagulacija iz lateksa
Kalcijev nitrat se uporablja v fazi koagulacije iz lateksa. Je del potopne raztopine, in ko pride v stik z raztopino, ki jo vsebuje lateks, prekine svojo stabilizacijo in povzroči svojo koagulacijo.
Prenos toplote in shranjevanje
Binarni mešanica staljenih nitratnih soli, vključno z kalcijami z drugimi nitrati.
Oblike uporabe
-Kalcijev nitrat, pomešan s tlemi, se nanese na koncentracijo 1,59 kg za 30,48 m2, z ustreznim namakanjem. Kalcijev nitrat je solubiliziran v vodi, kar omogoča absorpcijo s koreninami rastline. V hidroponskih pridelkih se raztopi v gojitveni vodi.
-Kalcijev nitrat v obliki pršila se uporablja tudi za brizganje listov in cvetov, saj je učinkovito zdravljenje pri preprečevanju gnilobe paradižnikove rože, plute in grenke luknje jabolka.
-Mešanici, ki tvori beton (cement, pesek, kamni in voda), dodajo količino kalcijevega nitrata in učinek dodajanja njega ima na specifične lastnosti betona; na primer nastavitev hitrosti in odpornosti.
-Kalcijev nitrat se doda ustrezni koncentraciji, da se zmanjša slabe vonja po odplakah ali ostanku, na raven, ki je vonjava dopustna za ljudi.
Reference
- Specifikacije kalcijevega nitrata. Okrevano od: Direct2Farmer.com
- Kalcijev nitrat. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov

