Dipolarni trenutek, kako se izračuna, in primeri

- 727
- 157
- Adrian Legros
On Dipolarni trenutek To je kemična lastnost, ki kaže, kako raznoliko se električni naboji porazdelijo v molekuli. Izraženo je v enotah Debye, 3,33 · 10-30 C · m in običajno njihove vrednosti segajo od 0 do 11 d.
Zelo polarne spojine imajo ponavadi velike dipolne trenutke; Medtem ko so apolarni, majhni dipolski trenutki. Bolj kot polarizirani so električni naboji v molekuli, večji je dipolski trenutek; to pomeni, da mora obstajati regija, bogata z elektroni, Δ- in drugo revno v elektroni, δ+.
 Dva barvni osnutek služi kot analogija z dvema poljama, pozitivnim in negativnim, molekule z označenim dipolnim momentom. Vir: Pexels.
Dva barvni osnutek služi kot analogija z dvema poljama, pozitivnim in negativnim, molekule z označenim dipolnim momentom. Vir: Pexels. Dipolni trenutek, μ.
Ko je molekula linearna, jo lahko primerjamo z dvokolesnim osnutkom. Njen negativni konec Δ-, ustreza bi rdeči barvi; Medtem ko bi bila pozitivna, Δ+, bi bila modra barva. Ko se veličine negativnih obremenitev povečujejo v δ-polu in razdalja, ki jo loči od δ+, se dipolski trenutek poveča.
Kemično zgornje pomeni, da večja je razlika v elektronegativnosti med dvema atomama in daljša je razdalja, ki ju ločuje, večji je dipolski moment med njima.
[TOC]
Kako se izračuna dipolski trenutek?
Velja za kovalentno povezavo med dvema atomama, A in B:
A-b
Razdalja med pozitivnimi in negativnimi delnimi obremenitvami je že določena z dolžino njegove povezave:
Doδ+-Bδ-
Ker imajo protoni in elektroni enako velikost električnega naboja, vendar z nasprotnimi znaki, 1.6 · 10-19C, to je upoštevano pri ocenjevanju dipolnega trenutka med A in B skozi naslednjo enačbo:
Lahko vam služi: razlike med organskimi in anorganskimi spojinamiμ = Δ ·d
Kjer je μ dipolski trenutek, je δ obremenitev elektrona brez negativnega znaka in d Dolžina povezave, izražena v metrih. Na primer ob predpostavki d Ima vrednost 2 Å (1 · 10-10m) Dipolni trenutek, μA-B bo:
μA-B = (1.6 · 10-19C) · (2 · 10-10m)
= 3.2 · 10-29C · m
Ker pa je ta vrednost zelo majhna, se uporablja enota Deby:
μ = (3,2 · 10-29C · m) · (1 d/3,33 · 10-30 C · m)
= 9,60 d
Ta vrednost μA-B bi lahko domnevala, da je povezava A-B bolj ionska kot kovalentna.
Primeri
Voda
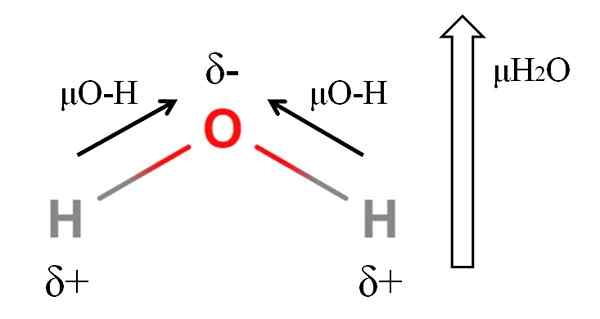 Dipoarski trenutek molekule vode. Vir: Gabriel Bolívar.
Dipoarski trenutek molekule vode. Vir: Gabriel Bolívar. Če želite izračunati dipolni trenutek molekule, morate dodati vse dipolne trenutke njihovih povezav, če upoštevate kote povezav in malo trigonometrije. To sprva.
Voda ima enega največjih dipolnih trenutkov, ki bi jih lahko pričakovali za kovalentno spojino. Na zgornji sliki imamo, da imajo vodikovi atomi pozitivne delne obremenitve, δ+, medtem ko kisik nosi negativno delno obremenitev, δ-. Povezava O-H je precej polarna (1.5D) in dva sta v molekuli H2Tudi.
Na splošno se vektor potegne iz manj elektronegativnega atoma (H) do najbolj elektronegativnega (O). Čeprav niso narisani, na atomu kisika obstajata dva para ne skupnih elektronov, ki "koncentrirajo" negativno območje še bolj.
Zaradi kotne geometrije h2Ali, dipolski trenutki se pridružijo v smeri atoma kisika. Upoštevajte, da bi vsota obeh μO-H dala 3D (1.5+1.5); Ampak ni tako. Dipolni trenutek vode ima eksperimentalno vrednost 1.85D. Tu je učinek tesnega kota 105 ° med povezavami H-O-H.
Lahko vam služi: laboratorijski termometer: značilnosti, za kaj je, uporaba, primeriMetanol
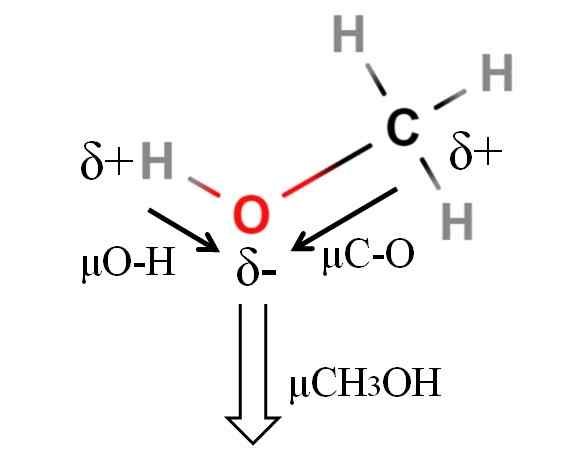 Dipoarski trenutek molekule metanola. Vir: Gabriel Bolívar.
Dipoarski trenutek molekule metanola. Vir: Gabriel Bolívar. Dipolni trenutek metanola je 1.69D. Je manj kot voda. Zato atomske mase v dipolnem trenutku nimajo preveč vpliva; Toda njegovi atomski radijski sprejemniki. V primeru metanola ne moremo potrditi, da ima vaša povezava H-O μ, enaka 1.5 D; Ker so molekularna okolja v CHO drugačna3Oh in h2Tudi.
Zato bi morali izmeriti dolžino povezave H-O v metanolu, da bi lahko izračunali μO-H. Kar je mogoče potrditi, je, da je μO-H večji od μC-O.
Metanol je katalogiziran kot eno najbolj polarnih topil, ki jih lahko najdemo skupaj z vodo in amonijakom.
Amoniak
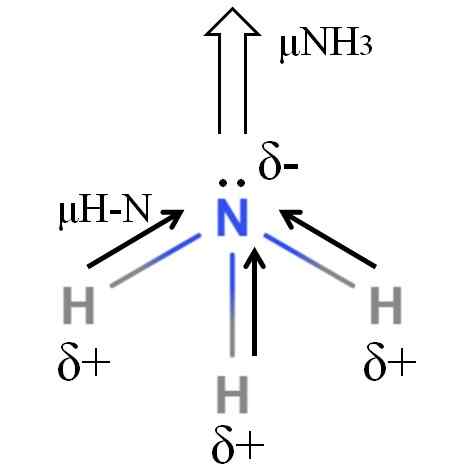 Dipoarski trenutek molekule amoniaka. Vir: Gabriel Bolívar.
Dipoarski trenutek molekule amoniaka. Vir: Gabriel Bolívar. H-N vezi so precej polarne, zato dušik, ki sledi večji elektronegativnosti. Poleg tega imamo na njem še nekaj nepadajočih elektronov, ki prispevajo njihove negativne obremenitve v regijo δ-. Zato električni naboji prevladujejo v atonijevem atonialnem atomu.
Amoniak ima dipolski trenutek 1.42d, manj kot metanol. Če bi tako amoniak kot metanol lahko spremenili v prepih.
Etanol
V primeru etanola, Cho3Pogl2Oh, vaš dipolni trenutek je zelo blizu metanola, vendar ima ponavadi nižje vrednosti. Če ima več ogljikovih atomov, ki sestavljajo δ+območje, atom kisika, ki predstavlja δ-, začne izgubljati nekoliko od svoje "relativne negativne intenzivnosti".
Vam lahko služi: dimetilamin ((CH3) 2NH): struktura, lastnosti, uporabe, tveganjaOgljikov dioksid
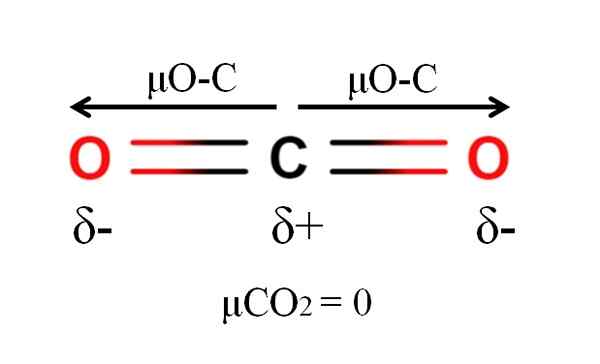 Dipoarski trenutek molekule ogljikovega dioksida. Vir: Gabriel Bolívar.
Dipoarski trenutek molekule ogljikovega dioksida. Vir: Gabriel Bolívar. Ogljikov dioksid ima dve polarni vezi, C = O, s svojimi dipolnimi trenutki μO-C. Vendar, kot je razvidno iz vrhunske slike, linearna geometrija co2 naredi dva μO-C vektorsko drug drugega, tudi če ima ogljik pozitivno delno obremenitev in negativne delne obremenitve kisika.
Zaradi tega je ogljikov dioksid apolarna molekula, ker μCO2 ima vrednost 0d.
Metan
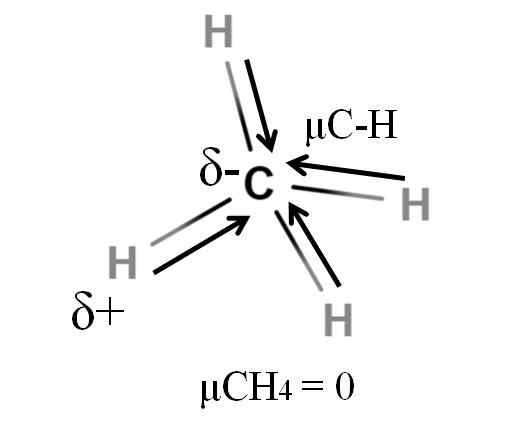 Dipolarni trenutek za molekulo metana. Vir: Gabriel Bolívar.
Dipolarni trenutek za molekulo metana. Vir: Gabriel Bolívar. Tako metan kot ogljikov dioksid imata nekaj skupnega: so zelo simetrične molekule. Na splošno je bolj simetrična molekula, manj bo njen dipolni trenutek.
Če vidimo molekulo CHO4, Njegove C-H vezi so polarne, elektroni pa so usmerjeni proti ogljikovi atomu, ker so nekoliko bolj elektronegativni. Lahko bi mislili, da bo ogljik moral biti zelo negativno območje δ; Kot osnutek s svojim intenzivnim rdečim središčem in modrikastimi konci.
Ko pa je CHO razdeljen4 V polovici bi dobili dve polovici H-C-H, eno na levi in drugi desno, podobno kot molekula H2Tudi. Tako se dipolski trenutek, ki je posledica dodajanja teh dveh μC-H, prekliče z drugo polovico. In torej, μCH4 ima vrednost 0d.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Walter J. Moore. (1963). Fizikalna kemija. V kemični kinetiki. Četrta izdaja, Longmans.
- Iran. Levine. (2009). Načela fizikalnokemije. Šesta izdaja, stran 479-540. MC Graw Hill.
- Čelada, Anne Marie, ph.D. (29. januarja 2020). Opredelitev dipolnega trenutka. Okreval od: Thoughtco.com
- Blaber Mike. (29. septembra 2019). Dipolski trenutki. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Larita Williams. (2020). Dipolni trenutek: definicija, enačba in primer. Študij. Okrevano od: študij.com
- Wikipedija. (2020). Vezni dipolni trenutek. Pridobljeno iz: v.Wikipedija.org
- « Plinsko osvetlitev, kako ga zaznati in 5 nasvetov, da se mu izognete
- Značilnosti, funkcije, vrste, primeri onomatopeja »

