Korpuskularni model snovi
- 3061
- 470
- Ms. Pablo Lebsack
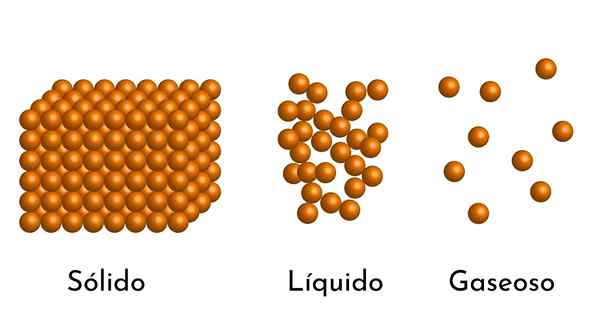
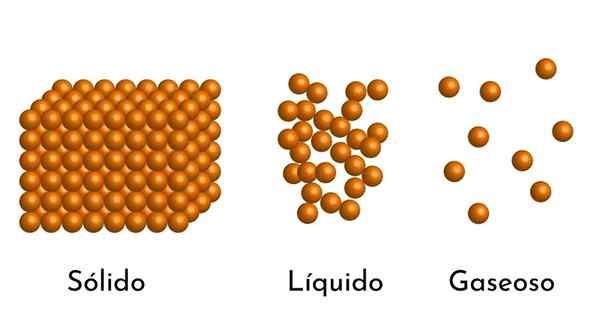 Najbolj znana stanja zadeve imajo svojo razlago v korpuskularnem modelu zadeve
Najbolj znana stanja zadeve imajo svojo razlago v korpuskularnem modelu zadeve Kakšen je korpuskularni model snovi?
On Korpuskularni model snovi To je model mikroskopske strukture snovi, ki želi razložiti lastnosti in vedenje v vsakem stanju združevanja.
Temeljni postulat modela je, da je snov sestavljen iz majhnih delcev, ki so lahko atomi, ioni ali molekule, vedno v neprekinjeni vznemirjenosti.
V tem modelu veljajo zakoni klasične mehanike za delce, čeprav jih po velikem številu ne preučujeta posamično, ampak s statistično obravnavo. Na ta način dobimo povprečne vrednosti makroskopskih velikosti, ki jih zanimajo, kot so tlak, temperatura in prostornina.
Korpuskularni model pojasnjuje tudi lastnosti, kot so viskoznost, trdota, prožnost in gostota materialov, med drugimi pojavi ter toplotno dilatacija.
Izvor trupkularnega modela snovi
Ideje o korpuskularni naravi snovi segajo vsaj 5. stoletje.C. V starodavni Grčiji Leucipo (450 a. C. - 370 a. C.) in demokratit (460 do 370 do c), učenec tega je špekuliral o organizaciji snovi na mikroskopski ravni.
Ti filozofi so predlagali, da je zadeva sestavljena iz drobnih nedeljivostnih delcev, imenovanih atomi, Beseda grške korenine, ki pomeni natančno "nedeljivo".
Teoriji je izključil Aristotel, najvplivnejši žajbelj svojega časa. Vendar pa je šele sedemnajstega stoletja korpuskularna teorija spet začela sprejemati pomen in v 19. stoletju so se skrivnosti materije končno začele razkrivati.
Leta 1803 je angleški kemik John Dalton (1766-1844) znova predlagal, da je zadevo tvoril truplo, imenovano Atomi, ki so v določenih razmerjih združili molekule snovi.
Daltonovi atomi so bili nedeljivi, kmalu pa je bila razvita trdna teoretična struktura, zlasti zahvaljujoč Jamesu C. Maxwell (1831-1979) in Ludwig Boltzmann (1844-1906). To je vzpostavilo temelje statistične mehanike in fizike trdnega stanja.
Lahko vam služi: povprečna hitrost: formule, kako se izračuna in rešiOsnove korpuskularnega modela snovi
Glavni postulati modela so:
- Zadeva, ne glede na njihov status združevanja, tvori mikroskopski delci, ki so lahko individualni ali kombinirani atomi, da tvorijo molekule.
- Različne snovi se med seboj razlikujejo, ker jih sestavljajo različni delci.
- Glede na stanje združevanja snovi so prazni prostori med delci, večji v plini in manjši v trdnih snovi.
- Delci, ki sestavljajo zadevo, so v večni vznemirjenosti. Za večjo vznemirjenje, večjo kinetično energijo, ki jo imajo, in če se doda toplota, se gibanje delcev poveča.
- Tudi v tekočinah in trdnih snovi imajo delci privlačnost različne intenzivnosti zaradi medmolekulskih sil. V plinih so molekule zelo ločene in se hitro premikajo, zato te sile nimajo večje pojavnosti. Toda v tekočinah, katerih delci imajo več kohezije, so te sile bolj intenzivne in v trdnih snovi so še večje.
Kinetična teorija plinov
Korpuskularni model je bil najprej uporabljen za pline, saj je najpreprostejše stanje združevanja in kohezijske sile med molekulami minimalno. Poleg tega so bile lastnosti plinov dobro znane z eksperimentalnimi deli angleškega kemika Roberta Boyleja in francoskega Josepha Gay Lussac in Jacquesa Charlesa.
Model idealnega plinov, najpreprostejši, predvideva, da:
- Velikost delcev je veliko manjša od razdalj med njimi in da dimenzije posode. So specifične mase, to je, da nimajo dimenzij in ne zasedajo volumna.
- Delci so v trajnem vznemirjenju, saj je njihovo gibanje samo v prevodu.
- Občasno se delci spopadajo elastično, drug z drugim in s stenami posode. V popolnoma elastičnih pretresih se ohrani kinetična energija.
- Med molekulami ni privlačnih sil. Edina interakcija so posledica trkov, ki se pojavljajo občasno in zelo kratek čas. Od ostalih, vsaka molekula deluje ne glede na druge.
- Če ni zunanjih sil, ki delujejo na sistem delcev, se te enakomerno porazdelijo v celotnem razpoložljivem volumnu.
Čeprav je to najpreprostejši model, pojasnjuje obnašanje katerega koli gostega plina pri visokih temperaturah in nizkih tlakih. Znanstveniki so razvili druge bolje prilagojene modele vedenja resničnih plinov, saj to menijo, da:
- Molekule imajo merljivo velikost.
- Intermolekularne sile niso preklicane.
Idealna enačba plina
Zahvaljujoč postulatom idealnega plina se pojavi izraz, ki povezuje makroskopske velikosti tlaka P, volumna V in temperature T:
P ∙ v = nrt
Kjer je n število molov plina in r, je univerzalna konstanta plinov, katerih vrednost v mednarodnih sistemskih enotah je 8.314 j/mol ∙ k.
Kinetična energija in temperatura
V idealnem plinu se vsa notranja energija kaže kot kinetična energija. Povprečna kinetična energija N molekul idealnega plina je neposredno sorazmerna s svojo temperaturo v Kelvinu:
Korpuskularni model v tekočinah in trdnih snovi
Pravzaprav je vse snovi mogoče v treh najpreprostejših stanjih: na primer plin, tekočina ali trdna, odvisno od tlaka in temperature. Obstajajo druga stanja združevanja, kot je plazma, vendar ne blizu površine zemlje.
Ta stanja so posledica načina delovanja sil medmolekulske privlačnosti, ki so kratke, to pomeni, da ne delujejo, če je razdalja med molekulami zelo velika in se delci premikajo z veliko hitrostjo. To je primer plinov, ki omogoča pojav difuzija hitreje. To pojasnjuje, da se aroma hitro širi z aromo.
Vam lahko služi: kaj je magnetni trenutek?Po drugi strani, ko so delci bližje in je njihovo gibanje počasneje, kot v tekočinah in trdnih snovi, imajo te medmolekularne sile možnost, da izvedejo svoje delovanje.
Ko se plin prehaja v tekoče stanje, se njegova prostornina zmanjša, ker se razdalja med njegovimi delci zmanjša in še več, ko postane trdna.
Zadeva v tekočem stanju
V tekočem stanju medmolekularne sile niso zaničevalne, ampak delujejo v manjšem obsegu kot v trdnem stanju. Delci tvorijo majhne skupine, ki se neprekinjeno razpadajo in preusmerijo, kar zagotavlja gibljivost materialu, čeprav ohranjajo fiksno volumen.
Ta mobilnost omogoča tekočine, da se prilagodijo obliki vsebnika in jim omogočajo, da se lažje pretokajo. Lahko pride do difuzije, vendar počasneje kot v plini.
Kljub temu imajo delci dovolj kohezije, tako da tekočina ostane nestisljiva v širokem temperaturnem območju.
Površinska napetost
Na površini tekočine obstajajo molekule, na katerih delujejo neuravnotežene medmolekularne sile, kar povzroča neto silo navzgor. Ta neto sila je zmanjšana, če ima tekočina najnižjo možno površino.
Zahvaljujoč tej sili, zatiči, sponki, žuželke in drugi majhni predmeti uspejo ostati na mirni površini vode, ne da bi se potopili.
 Na tej sliki je mogoče videti molekulo na površini tekočine, na kateri deluje neto sila, kar omogoča, da žuželka hodi po vodi
Na tej sliki je mogoče videti molekulo na površini tekočine, na kateri deluje neto sila, kar omogoča, da žuželka hodi po vodi Trdna država
V trdnem stanju so delci zelo blizu drug drugemu, medmolekularne sile pa delci ostanejo v fiksnih položajih. Čeprav lahko vibrirajo okoli tega položaja, trdne snovi sprejmejo definirano obliko in ohranjajo stalno volumen.
Ko toplota teče, se amplituda vibracijskega gibanja poveča in temperatura se poveča. To povzroči, da se telesne dimenzije povečujejo s temperaturo, ki se imenuje pojav Toplotna dilatacija. Če dovolj toplote teče, lahko trdna snov celo gre v tekočo fazo.


