Sommerfeld značilnosti atomskega modela, postulacije, prednosti in slabosti
- 4653
- 1374
- Ignacio Barrows
On Sommerfeld Atomski model Ustvaril ga je nemški fizik Arnold Sommerfeld med letoma 1915 in 1916. Sommerfeld je svoje rezultate najprej predstavil na Bavarski akademiji znanosti in jih nato objavil v reviji Annalen der Physik.
Model atoma, ki ga predlaga danski fizik Niels Bohr, opisuje.
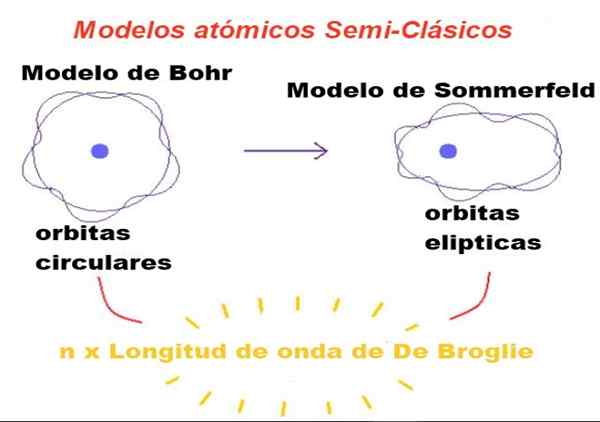
 Slika 1. V polklasičnih modelih so orbite newtonske, vendar le tiste, katerih obod je celo število, kar je dovoljeno valovno dolžino. Vir: f. Zapata.
Slika 1. V polklasičnih modelih so orbite newtonske, vendar le tiste, katerih obod je celo število, kar je dovoljeno valovno dolžino. Vir: f. Zapata. V teoriji, ki jo je predlagal Bohr, lahko elektron, ki kroži okoli jedra.
Bohr je tudi menil, da so te orbite krožne, in ena sama kvantna številka Glavna kvantna številka n = 1, 2, 3 ... služil za identifikacijo dovoljenih orbite.
Prva sprememba, ki jo je Sommerfeld uvedel modelu Bohr.
Obseg opisuje njegov polmer, toda za elipso morate poleg prostorske orientacije istega dati dva parametra: pol -senije in manjšo polovico -semi. S tem je predstavil še dve kvantni številki.
Druga glavna sprememba, ki jo je naredil Sommerfeld, je bila dodajanje relativističnih učinkov atomskemu modelu. Nič ni hitreje od svetlobe, vendar je Sommerfeld našel elektrone z občutno tesno hitrostjo, zato je bilo treba v kateri koli opis atoma vključiti relativistične učinke.
[TOC]
Postulati atomskega modela Sommerfeld
Elektroni sledijo krožnim in eliptičnim orbiti
Elektroni v atomu sledijo eliptični orbiti (krožni orbiti so poseben primer), njihovo energijsko stanje pa lahko označimo s 3 kvantne številke: glavno kvantno število n, Sekundarna kvantna številka ali azimutalna številka l in magnetno kvantno številko mL.
Vam lahko služi: binarne soliZa razliko od oboda ima elipsa večji polži in manjšo polovico.
Toda elipse z isto večjo polosno osi imajo lahko različni manjši pol -semi, odvisno od stopnje ekscentričnosti. Ekscentričnost, ki je enaka 0, ustreza krogu, zato ne izključuje krožnih usmeritev. Poleg tega imajo lahko v vesoljskih elipsah drugačne nagibe.
Zato je Sommerfeld svojemu modelu dodal sekundarno kvantno številko L, da je označil manjšo polovico in magnetno kvantno številko mL. Tako je opozoril, kakšne so dovoljene prostorske usmeritve eliptične orbite.
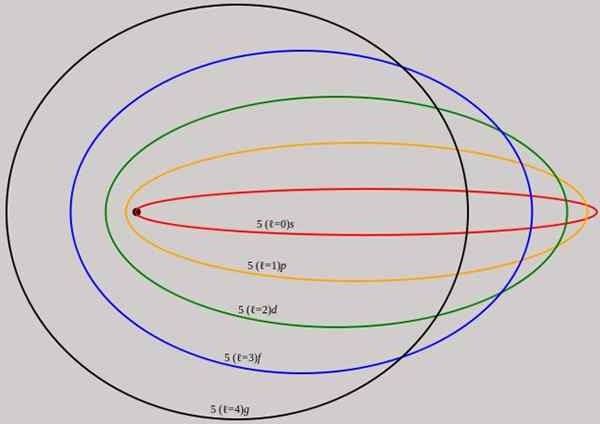 Slika 2. Orbite, ki ustrezajo ravni energije n = 5, so prikazane za različen kotni zagon l, ki imajo popolne valovne dolžine de broglie. Vir: Wikimedia Commons.
Slika 2. Orbite, ki ustrezajo ravni energije n = 5, so prikazane za različen kotni zagon l, ki imajo popolne valovne dolžine de broglie. Vir: Wikimedia Commons. Upoštevajte, da ne dodaja novih glavnih kvantnih števil, zato je skupna energija elektrona v eliptični orbiti enaka kot v modelu Bohr. Zato ni novih ravni energije, ampak razplet ravni, ki jo daje število n.
Zeeman Effect in Stark Effect
Na ta način je mogoče v celoti določiti določeno orbito, zahvaljujoč 3 omenjenim kvantnim številom in tako razložite obstoj dveh učinkov: Zeeman učinek in Stark Effect.
In tako pojasnjuje razkrivanje energije, ki se pojavlja v običajnem Zeeman učinku (obstaja tudi anomalen Zeeman učinek), v katerem je spektralna črta razdeljena na več komponent, ko je v prisotnosti magnetnega polja.
To odvijanje linij se pojavlja tudi v prisotnosti električnega polja, ki je znan kot Stark Effec.
Atomsko jedro in elektroni se gibljejo okoli njegovega masnega središča
Potem ko je Ernest Rutherford odkril atomsko jedro in da je dejstvo, da je tam koncentrirana skoraj celotna masa atoma.
Lahko vam služi: litijev hidroksid (LIOH)Vendar je Sommerfeld predstavil, da se jedro in elektroni v orbiti premikajo po množičnem središču sistema, kar je seveda zelo blizu jedru. Njegov model uporablja zmanjšano maso sistema elektronov - nukleus, namesto elektronske mase.
V eliptičnih orbitah, tako kot pri planeti okoli sonca, obstajajo časi, ko je elektron bližje, v drugih pa dlje od jedra. Zato je njegova hitrost na vsaki točki njegove orbite drugačna.
 Slika 3.- Arnold Sommerfeld. Vir: Wikimedia Commons. Gfhund [cc do 3.0 (https: // creativeCommons.Org/licence/by/3.0)].
Slika 3.- Arnold Sommerfeld. Vir: Wikimedia Commons. Gfhund [cc do 3.0 (https: // creativeCommons.Org/licence/by/3.0)]. Elektroni lahko dosežejo relativistične hitrosti
Sommerfeld je v svoj model predstavil konstanto fine strukture, konstanta brez dimenzij, povezanih z elektromagnetno silo:
α = 1/137.0359895
Opredeljen je kot količnik med obremenitvijo elektronov in Square visoko in izdelek med Planckovo konstanto h in hitrost svetlobe c V vakuumu, vse pomnožene z 2π:
α = 2π (e2/h.c) = 1/137.0359895
Konstanta fine strukture povezuje tri najpomembnejše konstante atomske fizike. Druga je masa elektrona, ki se tukaj ne pojavi.
Na ta način je povezan z elektroni s fotoni (ki se premikajo s hitrostjo c v praznini) in tako pojasnijo odstopanja nekaterih spektralnih črt vodikovega atoma napovedi po modelu Bohr.
Zahvaljujoč relativističnim popravkom, ravni energije z enakimi n Toda drugače l Ločujejo se, kar povzroča strukturo fine strukture, od tam ime konstante α.
In vse značilne dolžine atoma je mogoče izraziti v smislu te konstante.
 Slika 4. Prikazana je kvantizacija kotnega trenutka L. Za razliko od krožnih orbite, eliptične. Vir: f. Zapata.
Slika 4. Prikazana je kvantizacija kotnega trenutka L. Za razliko od krožnih orbite, eliptične. Vir: f. Zapata. Prednosti in slabosti
Prednosti
-Sommerfeld je pokazal, da ena sama kvantna številka ni zadostna za razlago spektralnih linij vodikovega atoma.
-Prvi model je predlagal prostorsko kvantizacijo, saj so projekcije orbite v smeri elektromagnetnega polja kvantizirane.
Lahko vam služi: Plazemsko stanje: značilnosti, vrste in primeri-Model Sommerfelda je zadovoljivo pojasnil, da se elektroni z isto glavno kvantno številko N razlikujejo v svojem energetskem stanju, saj imajo lahko različna kvantna številka L in ML.
-Uvedel konstantno α za razvoj fine strukture atomskega spektra in razložiti Zeeman učinek.
-Vključevala je relativistične učinke, saj se lahko elektroni premikajo s hitrostmi, precej blizu hitrosti svetlobe.
Slabosti
-Njegov model je bil uporaben samo za atome z elektronom in v marsičem za atome alkalnih kovin, kot je Li2+, Vendar v atomu helija ni koristno, ki ima dva elektrona.
-Ni razložil elektronske porazdelitve v atomu.
-Model je omogočil izračun energije dovoljenih stanj in frekvence izdanega ali absorbiranega sevanja v prehodih med državami, ne da bi dal informacije o časih teh prehodov.
-Zdaj je znano, da elektroni ne sledijo poti z vnaprej določenimi oblikami kot orbitami, ampak da zasedajo Orbitale, vesoljske regije, ki ustrezajo Schrodingerjevim rešitvam.
-Model poljubno združuje klasične vidike s kvantnimi vidiki.
-Ni uspel razložiti anomaliznega Zeemanskega učinka, saj to potrebuje model Dirac, ki je kasneje dodal še eno kvantno številko.
Zanimivi članki
Schrödinger Atomski model.
Broglie Atomski model.
Chadwick Atomski model.
Heisenberg Atomski model.
Perrin atomski model.
Thomson Atomski model.
Dalton Atomski model.
Atomski model Dirac Jordan.
Atomski model Leucipo.
Atomski model Bohr.
Trenutni atomski model.
Reference
- Brainkart. Sommerfeld Atom model in njegove pomanjkljivosti. Okrevano od: Brainkart.com.
- Kako smo spoznali kozmos: Light & Matter. Sommerfeldov atom. Pridobljeno iz: okusargarden.co.Združeno kraljestvo
- Parker, str. Atom bohr-sommerfeld. Obnovil od: Physnet.org
- Izobraževalni kotiček. Sommerfeld model. Okrevano od: RINCINCONUCTIVE.com.
- Wikipedija. Sommerfeld Atomski model. Okrevano od: je.Wikipedija, org.

