Schrödinger Atomski model

- 3296
- 32
- Ms. Pablo Lebsack
Kaj je Schrödingerjev atomski model?
On Schrödinger Atomski model To je predlog za delovanje in strukturo atoma, ki ga je razvil Erwin Schrödinger leta 1926. Znan je kot kvantni mehanski model atoma in opisuje vedenje valov elektrona.
Za to je izjemni avstrijski fizik temeljil na hipotezi Broglie, ki je izjavil, da je vsak premični delček povezan z valom in se lahko kot takšen obnaša.
 Erwin Schrödinger
Erwin Schrödinger Schrödinger je predlagal, da gibanje elektronov v atomu ustreza dvojnosti valovnih delcev in posledično bi se lahko elektroni mobilizirali okoli jedra kot stacionarne valove.
Schrödinger, ki je leta 1933 prejel Nobelovo nagrado za svoje prispevke k atomski teoriji, je razvil istoimensko enačbo za izračun verjetnosti, da bo elektron v določenem položaju.
Značilnosti atomskega modela Schrödinger
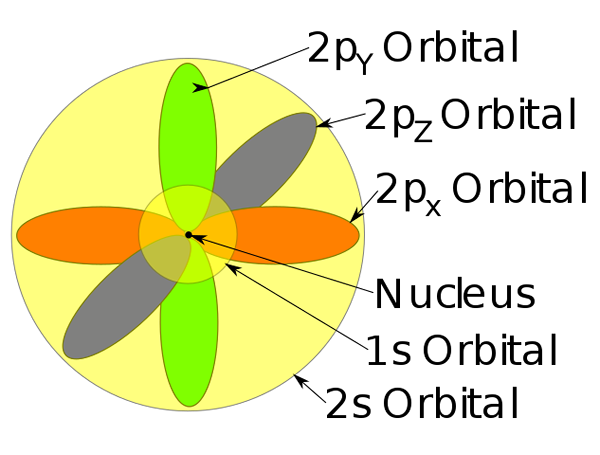 Orbitale 1s, 2s in 2p znotraj atoma natrija.
Orbitale 1s, 2s in 2p znotraj atoma natrija. -Ta atomski model opisuje gibanje elektronov kot stacionarnih valov.
-Elektroni se nenehno gibljejo, torej nimajo fiksnega ali določenega položaja znotraj atoma.
-Ta model ne napoveduje lokacije elektronov, niti ne opisuje poti, ki jo izvaja znotraj atoma. Vzpostavi le območje verjetnosti za iskanje elektrona.
-Ta verjetnostna območja se imenujejo atomske orbitale. Orbitale opisujejo prevajalsko gibanje okoli jedra atoma.
-Te atomske orbitale imajo različne ravni in energijske ravni in jih je mogoče določiti med oblaki elektronov.
-Model ne razmišlja o stabilnosti jedra, ampak se nanaša le, da pojasni kvantno mehaniko, povezano z gibanjem elektronov znotraj atoma.
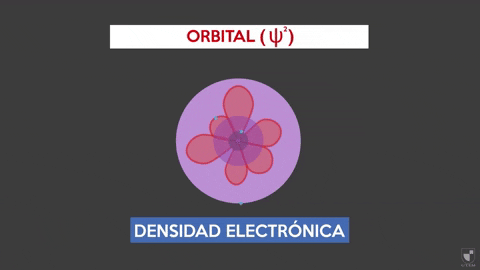 Elektronska gostota kaže na verjetnost iskanja elektrona v bližini jedra. Bližje jedra (vijolična cona) bo več verjetnosti, medtem ko bo manj, če se boste oddaljili od jedra (vijolično območje).
Elektronska gostota kaže na verjetnost iskanja elektrona v bližini jedra. Bližje jedra (vijolična cona) bo več verjetnosti, medtem ko bo manj, če se boste oddaljili od jedra (vijolično območje). Poskus
Atomski model Schrödingerja temelji na hipotezi Broglie, pa tudi na prejšnjih atomskih modelih Bohr in Sommerfelda.
Vam lahko služi: dinamično ali kinetično trenje: koeficient, primeri, vajeBroglie je predlagal, da imajo tako kot valovi delce, delci imajo lastnosti valov, pri čemer imajo povezano valovno dolžino. Nekaj, kar je takrat ustvarilo veliko pričakovanja, saj je bil sam Albert Einstein v svoji teoriji.
Vendar je Brogliejeva teorija imela pomanjkanje, kar je bilo, da pomen lastne ideje ni bil zelo dobro razumljiv: elektron je lahko val, kaj pa kaj? Takrat se zdi, da je figura Schrödingerja odgovorila.
Da bi to storil, se je avstrijski fizik zanašal na Youngov eksperiment in na podlagi lastnih opazovanj je razvil matematični izraz, ki nosi njegovo ime.
Nato znanstveni temelji tega atomskega modela:
Young's Experiment: Prva demonstracija dvojnosti valovnih delcev
Brogliejeva hipoteza o valovitosti in truplom naravi subjekta lahko dokažemo z Youngovim eksperimentom, znanim tudi kot eksperiment z dvojno režo.
Angleški znanstvenik Thomas Young je postavil temelje Schrödingerjevega atomskega modela, ko je leta 1801 izvedel poskus, da bi preveril valovito naravo svetlobe.
Med svojim eksperimentiranjem je Young razdelil emisijo svetlobe, ki prečka majhno luknjo skozi opazovalno komoro. Ta delitev je dosežena z uporabo 0,2 milimetrske kartice, ki se nahaja vzporedno z žarek.
Zasnova poskusa je bila narejena, da je svetlobni žarek širši od kartice, tako da je kartico postavil vodoravno, žarek je bil razdeljen na približno iste dele. Izhod svetlobnih žarkov je bil usmerjen z ogledalom.
Vam lahko služi: sile na daljavoOba žarka svetlobe sta udarila v steno v temni sobi. Tam je bil dokazan vzorec motenj med obema valovoma, kar je bilo dokazano, da se lahko svetloba obnaša toliko kot delček in val.

Stoletje pozneje je Albert Einsten idejo okrepil z načeli kvantne mehanike.
Schrödingerjeva enačba
Schrödinger je razvil dva matematična modela in razlikoval, kaj se zgodi, odvisno od tega, ali se kvantno stanje sčasoma spreminja ali ne.
Za atomsko analizo je Schrödinger objavil konec leta 1926.
To pomeni, da se val ne premika, njena vozlišča, to je ravnotežna točka.
Schrödinger je valove, ki opisujejo elektrone kot stacionarna ali orbitalna stanja, opredelili in so povezani na različnih ravneh energije.
Schrödingerjeva neodvisna časovna enačba je naslednja:
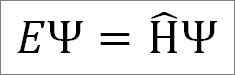
Kje:
In: Konstantna sorazmernost.
Ψ: Funkcija valov kvantnega sistema.
Η ̂: Hamiltonijski operater.
Neodvisna časovna enačba Schrödingerja se uporablja, kadar je opazen, ki predstavlja skupno energijo sistema, znano kot Hamiltonov operater, ni odvisen od časa. Vendar bo funkcija, ki opisuje skupno gibanje valov, vedno odvisna od časa.
Schrödingerjeva enačba kaže, da če imate valovno funkcijo ψ, in Hamiltonov operater deluje nanjo, konstantno sorazmernost in predstavlja skupno energijo kvantnega sistema v enem od njegovih stacionarnih stanj.
Lahko vam služi: diskretna spremenljivka: značilnosti in primeriČe se elektron uporablja za Schrödingerjev atomski model.
Z matematičnega vidika obstaja več rešitev za Schrödingerjevo enačbo, vsaka rešitev pomeni drugačno vrednost za konstanto sorazmernosti in.
Po Heisenbergovem načelu negotovosti ni mogoče oceniti položaja ali energije elektrona. Posledično znanstveniki priznavajo, da je ocena lokacije elektronov znotraj atoma netočna.
Postulati atomskega modela Schrödingerja
Postulati Schrödingerjevega atomskega modela so naslednji:
-Elektroni se obnašajo kot stacionarni valovi, ki se porazdelijo v vesolju glede na valovno funkcijo ψ.
-Elektroni se premikajo znotraj atoma, ki opisuje orbitale. To so področja, kjer je verjetnost iskanja elektrona bistveno večja. Zgoraj omenjena verjetnost je sorazmerna s kvadratom valovne funkcije ψ2.
Elektronska konfiguracija atomskega modela Schrödinguerja pojasnjuje periodične lastnosti atomov in povezav, ki tvorijo.
Vendar Schrödingerjev atomski model ne razmišlja o vrtenju elektronov in ne upošteva sprememb hitrih elektronov zaradi relativističnih učinkov zaradi relativističnih učinkov.
Zanimivi članki
Broglie Atomski model.
Chadwick Atomski model.
Heisenberg Atomski model.
Perrin atomski model.
Thomson Atomski model.
Dalton Atomski model.
Atomski model Dirac Jordan.
Atomski model Demokrita.
Atomski model Leucipo.
Atomski model Bohr.
Sommerfeld Atomski model.
Trenutni atomski model.
Reference
- Kvantni mehanski model atoma, ki je bil obnovljen od: je.Khanacademy.org
- Schrödingerjeve valovne enačbe.F.). Jaime I Univerza. Castellón, Španija. Okreval od: uji.je
- Sodobna atomska teorija: modeli. © ABCTE. Okrevano od: Abcte.org
- Schrodingerjev atomski mod.F.). Okrevano od: erwinschrodingerbiografija.Weebly.com
- Wikipedia, brezplačna enciklopedija. Schrödingerjeva enačba. Okrevano od: je.Wikipedija.org
- Wikipedia, brezplačna enciklopedija. Mladi eksperiment. Okrevano od: je.Wikipedija.org

