Atomski model Bohr
- 4983
- 1476
- Don Nitzsche
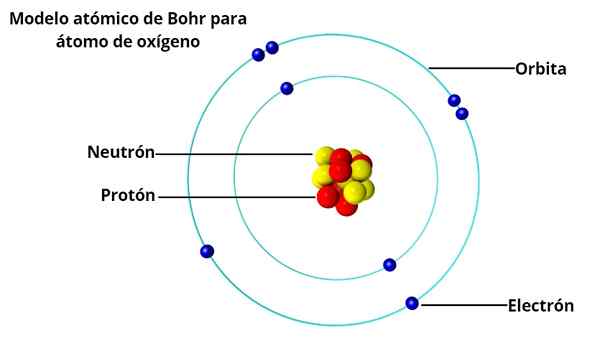
On Atomski model Bohr To je koncept danskega fizika Nielsa Bohrja (1885-1962) o strukturi atoma, objavljene leta 1913. V atomu Bohr elektroni okoli kvantizacija.
Za BOHR slika atoma kot miniaturnega osončja, z elektroni z orbiranjem okoli jedra, ni bila povsem skladna z dejstvom, da električni naboji, ko se pospešijo.

Takšen atom ne bi bil stabilen, ker bi se končal, da bi se prej ali slej zrušil, ker bi se elektroni spiralno oborili z jedrom. In do takrat, pred 50 leti, značilni svetlobni vzorci, ki oddajajo vodik in druge pline pri segrevanju.
Vzorec ali spekter je sestavljen iz niza svetlih črt nekaterih zelo specifičnih valovnih dolžin. In atom vodika se ne zruši z oddajanjem svetlobe.
Da bi pojasnil, zakaj je atom stabilen, kljub temu, da lahko seva elektromagnetno energijo, je Bohr predlagal, da bi kotni zagon lahko sprejel le določene vrednosti in s tem tudi energijo. To je tisto, kar razumemo s kvantizacijo.
Če sprejmemo, da je bila energija kvantizirana, bi imel elektron potrebno stabilnost, da ne bi hitel proti jedru, ki uničuje atom.
In atom izžareva svetlobno energijo le, ko elektron prehaja iz ene orbite v drugo, vedno v diskretnih količinah. Na ta način je razložena prisotnost emisijskih vzorcev v vodiku.
Bohr je na ta način sestavil vizijo atoma, ki vključuje znane koncepte klasične mehanike z novo odkrito, kot so Planckova konstanta, foton, elektron, atomsko jedro (Rutherford je bil mentor Bohr) in prej omenjeni spekter izdaje.
[TOC]
Glavne značilnosti modela Bohr
 Bohrjev atom. Animacija predstavlja elektron, ko gre od višje stopnje energije do druge manj energije, kar oddaja luč svetlobe (foton). Vir: Wikimedia Commons.
Bohrjev atom. Animacija predstavlja elektron, ko gre od višje stopnje energije do druge manj energije, kar oddaja luč svetlobe (foton). Vir: Wikimedia Commons. Atomski model Bohrja predvideva, da se elektron premika v krožni orbiti okoli jedra z delovanjem elektrostatične privlačnosti kuloma in predlaga, da se kotni zagon elektrona kvantizira.
Vam lahko služi: uravnoteženje vektorja: izračun, primeri, vajePoglejmo, kako vključiti oba koncepta v matematično obliko:
Naj bo velikost kotnega zagona, m masa elektrona in hitrost elektrona in r polmer orbite. Za izračun l imamo:
L = m⋅r⋅v
Bohr je predlagal, da je L enak celim večkratnim konstantnim h/2π, kjer je h Planck Constant, Pred kratkim ga je predstavil fizik Max Planck (1858-1947) pri reševanju energijskega problema, ki ga oddaja črno telo, teoretični objekt, ki absorbira vso svetlobno svetlobo.
Njegova vrednost je h = 6.626 × 10−34 J ・ s, medtem ko je pri H/2π označen kot ħ, To se glasi "H bar".
Zato kotni zagon L ostane:
m⋅r⋅v = nħ, Z n = 1,2, 3 ..
In iz tega stanja so sklenjeni radijski sprejemniki orbite, ki so dovoljeni za elektron, kot bomo videli.
Izračun polmera elektronske orbite
V nadaljevanju bomo prevzeli najpreprostejše atome: Hydrogen, ki je sestavljen iz enega samega protona in elektrona, tako z obremenitvijo magnitude kot.
Centripetalna sila, ki ohranja elektron v svoji krožni orbiti, zagotavlja elektrostatično privlačnost, katere velikost F je:
F = ke2/r2
Kjer je k elektrostatična konstanta Coulomb in R zakona razdalja elektronov-beljakovin. Vedeti, da v krožnem gibanju centripetalni pospešekc Daje ga razlog med kvadratom hitrosti in razdaljo R:
doc = v2 / r
Po drugem zakonu Newtona je neto sila produkt mase M s pospeševanjem:
MV2/r = ke2/r2
Dobimo poenostavitev radia R:
M⋅V2R = ke2
Z združevanjem tega izraza z kotnim zagonom imamo sistem enačb, ki ga daje:
Lahko vam služi: fizična usmeritev: značilnosti, vrste, primeri in vaje1) MV2R = ke2
2) r = n ħ/MV
Ideja je rešiti sistem in določiti r, polmer dovoljene orbite. Majhna osnovna algebra vodi k odgovoru:
R = (nħ)2 / K⋅m⋅E2
Z n = 1, 2, 3, 4, 5 ..
Za n = 1 imamo najmanj radijskih sprejemnikov, imenovanih Bohr radio atudi Z vrednostjo 0,529 × 10−10 m. Radijski sprejemniki drugih orbitov so izraženi v smislu dotudi.
Na ta način Bohr predstavi glavno kvantno številko n, poudarja, da dovoljeni radijski sprejemniki temeljijo na konstanti Planck, elektrostatični konstanti ter masi in obremenitvi elektrona.
Atomski model bohr postulira
 Danski fizik Niels Bohr (1885-1962).
Danski fizik Niels Bohr (1885-1962). Bohr spretno združuje newtonsko mehaniko z novimi odkritji, ki so se v drugi polovici 19. stoletja in začetku 20. stoletja nenehno dajala. Med njimi je revolucionarni koncept "koliko", od tega je sam Planck trdil, da ni zelo prepričan.
Bohr bi lahko s svojo teorijo zadovoljivo razložil serijo vodikovega spektra in napovedal energijske emisije v rangu ultravijoličnega in infrardečega, ki še ni bilo opaziti.
Vaše postulate lahko povzamemo na naslednji način:
Elektroni opisujejo krožne usmeritve
Elektron se vrti okoli jedra v stabilni krožni orbiti, z enakomernim krožnim gibanjem. Gibanje je posledica elektrostatične privlačnosti, ki jo na njem izvaja jedro.
Kotni zagon je kvantiziran
Kotni zagon elektrona je kvantiziran glede na izraz:
L = mvr = nħ
Kjer je n celo število: N = 1, 2, 3, 4 ..., kar vodi v elektron, je lahko le v določenih definiranih orbitah, katerih radijski sprejemniki so:
R = (n ħ)2 / k m e2
Elektroni oddajajo ali absorbirajo fotone, ko se premikajo iz enega energetskega stanja v drugo
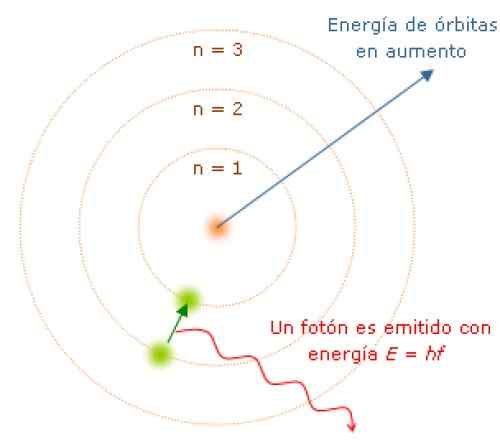
 Ko se premikajo iz enega energetskega stanja v drugo, elektroni absorbirajo ali oddajajo energijo v diskretnih količinah, imenovanih fotoni. Vir: Wikimedia Commons.
Ko se premikajo iz enega energetskega stanja v drugo, elektroni absorbirajo ali oddajajo energijo v diskretnih količinah, imenovanih fotoni. Vir: Wikimedia Commons. Ker je kotni zagon kvantiziran, energija in tudi. Lahko je dokazano, da je E podan z:
Vam lahko služi: navpični posnetek: formule, enačbe, primeri
Volt elektron ali EV je druga enota za energijo, ki se pogosto uporablja v atomski fiziki. Negativni znak energije zagotavlja stabilnost orbite, kar kaže, da je treba delo opraviti za ločitev elektrona od tega položaja.
Medtem ko je elektron v svoji orbiti, ne absorbira ali oddaja svetlobe. Ko pa skoči iz orbite večje energije na nižjo.
Pogostost F oddajne svetlobe je odvisna od razlike med stopnjami energije orbitov:
E = hf = ezačetno - efinale
Omejitve
Model Bohr ima določene omejitve:
-Uspešno velja le za atom vodika. Poskusi, da bi ga uporabili za bolj zapletene atome, niso delovali.
-Ne odziva, zakaj so nekatere orbite stabilne, druge. Dejstvo, da je bila energija v atomu kvantizirana, je delovala zelo dobro, vendar model ni dal razloga in to je znanstvenikom povzročilo nelagodje.
-Druga pomembna omejitev je, da ni pojasnila dodatnih vrstic, ki so jih izdali atomi v prisotnosti elektromagnetnih polj (Zeeman Effect in Stark Effect). Ali zakaj so bile nekatere spektralne črte bolj intenzivne kot druge.
-Model BOHR ne upošteva relativističnih učinkov, kar je potrebno.
-Za samoumevno je, da je mogoče natančno vedeti položaj in hitrost elektrona, toda resnično izračunano je verjetnost, da elektron zaseda določen položaj.
Kljub omejitvam je imel model takrat velik uspeh, ne le za vključevanje novih odkritij z že znanimi elementi, ampak tudi zato, ker je pokazal nova vprašanja, kar je jasno, da je pot do zadovoljive razlage atoma v kvantni mehaniki.
Zanimivi članki
Schrödinger Atomski model.
Broglie Atomski model.
Chadwick Atomski model.
Heisenberg Atomski model.
Perrin atomski model.
Thomson Atomski model.
Dalton Atomski model.
Atomski model Dirac Jordan.
Atomski model Demokrita.
Atomski model Leucipo.
Sommerfeld Atomski model.
Trenutni atomski model.


