Značilnosti miozina, struktura, vrste in delovanje
- 5090
- 1634
- Don Nitzsche
The Miozin Gre. Energija, ki poganja premik miozina, izvira iz hidrolize ATP. Zaradi tega je miozin običajno opredeljen kot encim mekanokemije.
V evkariotih je miozin zelo obilen beljakovine. Obstajajo različne vrste miozina, ki jih kodira družina genov. V kvasovkah se razlikujejo 5 razredov, na desetine pa pri sesalcih.
 Vir: David Richfield (uporabnik: Slashme) Ko uporabljate to sliko v zunanjih delih, jo lahko navedemo na naslednji način: Richfield, David (2014). "Medicinska galerija Davida Richfielda". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002–4436. [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]]
Vir: David Richfield (uporabnik: Slashme) Ko uporabljate to sliko v zunanjih delih, jo lahko navedemo na naslednji način: Richfield, David (2014). "Medicinska galerija Davida Richfielda". Wikijournal of Medicine 1 (2). Doi: 10.15347/WJM/2014.009. ISSN 2002–4436. [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]] Miozin ima najrazličnejše funkcije. Miozin, poleg aktina, sodeluje pri gibanju keratocitov.
Miozin II zagotavlja togost plazemski membrani, sodeluje v citokinezi in krčenju mišic. Oba, miozina I in II, sodelujeta s celično migracijo. Miosinas I in V izvajata prevoz veziklov vzdolž aktinskih filamentov.
[TOC]
Struktura
V elektronskih mikrografih ima tipična struktura miozina izoforme tri domene: glava, vrat in rep. S hidrolizo s himotripsinom, segmentom, sestavljenim iz glave in vratu, se imenuje težki meromiozin (HMM), in repnega segmenta, imenovanega lahki meromiozin (LMM).
Obvladovanje glave je N-terminalni konec težke verige, domena repa.
Razrede miozinov lahko razlikujemo s številom polipeptičnih verig, ki ga sestavljajo, ter o številčnosti in lahki verigi združenih naokoli.
Miozin I ima polipeptidno verigo, ki tvori glavo in njegov rep nima alfa helikodalnih regij. Medtem ko imata miozina in V dve polipeptidni verigi, in tam.
Myosinas I in V imata sindikalna mesta do kalmodulina, ki ureja in popravlja CA+2, V lahkih verigah. Miosina, ki sem jo popravil+2 V lahkih verigah, vendar to počne drugače kot kalmodulin.
Značilnosti
Na mehanski ravni imajo miozine tri značilnosti, in sicer:
- Vodja miozina je motorična domena, ki napreduje z diskretnimi koraki: Zveza miozina v aktin nit. Ta postopek je cikličen in je odvisen od ATP.
- Spremembe konformacije: Hidroliza molekule ATP je povezana na vsakem koraku molekule miozina, s pomočjo stopnje ojačanja in prenosa. To pomeni velike konformacijske spremembe miozina.
Vam lahko služi: radialna simetrijaPrva stopnja amplifikacije nastane zaradi izgube gama-fosfatne skupine ATP, ki omogoča reorganizacijo strukturnih elementov na mestu Unije ATP. Ta reorganizacija je usklajena s strukturnimi spremembami na mestu zveze do Actina.
Druga stopnja amplifikacije pomeni sporočanje konformacijske spremembe na aktivnem mestu z strukturnimi komponentami terminalnega karboksila.
- Usmerja: Ugotovljeno je bilo, da ima rudnik polarnost ali obratno usmeritev proti koncu (+) aktinske filamenta. Ta sklep izvira iz izravnalnih poskusov aktinske filamente z uporabo fluorescenčnega optičnega mikroskopa.
Funkcije
Miozin poleg aktina sodeluje pri krčenju mišic, celični adheziji, citokinezi, ki podeljuje togost kortikalne membrane in premik nekaterih veziklov, med drugimi funkcijami.
Napake miozina lahko povzročijo patološke razmere. Na primer, napake v miozinah I in V so povezane z miopatijami zaradi motenj miozina in pigmentacije (Griselli sindrom). Medtem ko motnje v miozinskih izoformah VI povzročajo izgubo ušesa.
Krčenje mišic
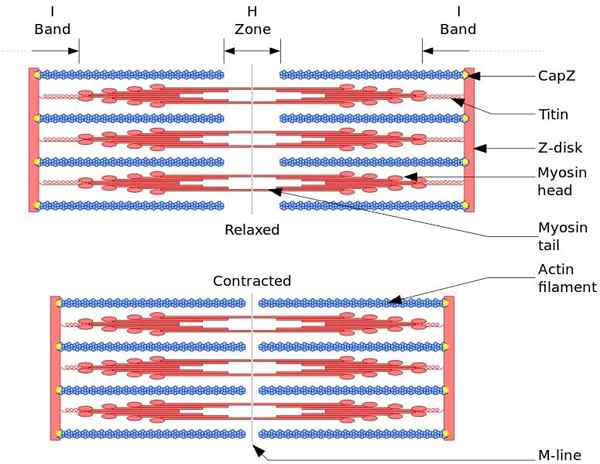
Funkcionalna in strukturna enota skeletnih mišic je sarcomro. Med krčenjem mišic dolžina sarcomerja doseže 30% prvotne dolžine.
Sarcomere so sestavljene iz debelih, miozina in tankih filamentov aktina, ki so organizirani na zapleten način. Na splošno se miozinske glave nahajajo na distalnih koncih nitke in njegovih repov proti središču Sarcomera, organizacija pa bipolarna.
Za krčenje mišic se morajo miozinske glave nasprotnih koncev premakniti na z disk z ali na konec (+) nitke. Ker je organizacija debelih filamentov bipolarna, pride do drsanja tankih filamentov na debelih nitih, ki jih poganja ATP.
Sila premika se pojavi, ker na stotine miozinskih glav, debele filamente.
Citocineza
Med mitozo, ko se mikrotubule vretena ločijo, aktin in miozin II tvorita kontraktilni obroč v celici celice. Ta prstan krši svoj premer in celico deli na dva dela.
Podelitev togosti kortikalnim membranam
V mutiranih celicah, ki nimajo miozina II, se plazemska membrana zlahka deformira, ko se nanese zunanja sila. To se zgodi, ker miozin II zagotavlja agregacijsko silo beljakovine v plazemski membrani.
Vam lahko služi: morfološka prilagoditevCelična adhezija
V epitelijskem tkivu se kontraktilni žarek aktina in miozina II nahajajo v soseskah plazemske membrane in tvorijo krožni pas, ki obdaja površino celične celice. Ta krožni pas določa obliko celice in vzdržuje zvezo med celicami.
Stik med celicami se zgodi s krožnim pasom do molekul celične adhezije z uporabo vezavnih beljakovin.
Premik nekaterih veziklov
Eksperimentalni dokazi razkrivajo, da miozin V izvaja membranski transport iz Golgijevega aparata do obrobja celice. Nekateri dokazi so:
- V celicah živčnega tkiva je bilo z imunofluorescenco astrocitov ugotovljeno, da se miozin V nahaja poleg Golgija.
- V kvasovkah mutacije v miozinu V genu prekinejo izločanje beljakovin in posledično se beljakovine nabirajo v citosolu.
- Miozin I izoformi so zadolženi za prevoz vakuole do celične membrane. Z uporabo specifičnih protiteles proti izoformi miozina I je bilo ugotovljeno, da so te izoforme v različnih delih celice.
Na primer, ko je živa ameba označena s protitelesom proti miozinu IC, se prevoz vakuole do membrane aretira. Zaradi tega se vakuola razširi in celica eksplodira.
Bolezni, povezane z miozinom
Miozine in izguba ušesa
Obstajajo številni geni in mutacije, ki povzročajo izgubo ušesa. Ta bolezen je pogosto monogenetska .
Mutacije v nekonvencionalnih miozinah z eno ali dvema glavama miozina vplivajo na delovanje notranjega ušesa. Nekateri mutirani miozinski isaformi so miozin IIIA, miozina VIIA in miozin XVA. Pred kratkim sta bila odkrita dve mutaciji v miozinu VI.
Mutacije v miozinu VI so c.897G> T in P.926Q. Prva mutacija vpliva na regijo, ki deluje z aktivnim nahajanjem, imenovanim stikalo. Homozigotno za mutacijo zgodaj kažejo fenotip, kar povzroča hude učinke.
Druga mutacija vpliva na območje obremenitve z obremenitvijo, v alfa propelerju v repu miozina VI. Ta regija je pomembna za proksimalno dimerizacijo motorja in vpliva na funkcijo stereo-kart miozina VI.
Lahko vam služi: pomožne znanosti o biologijiDruga mutacija je p.ASN207Ser, ki proizvaja motor, ki ne more ustvariti trdnosti. To je zato, ker je ASN 207 aminokislinski ostanek aktivnega mesta, katerega funkcija je zveza in hidroliza ATP.
Mutacija str.Arg657trp proizvaja izgubo funkcije miozina VI. Ostanek ARG je vključen v konformacijske spremembe, ki pritrjujejo hidrolizo na gibanje miozina.
Miozin x in rak
Myosina X (MyO10) je nekonvencionalen miozin, ki se izraža v možganih, endoteliji in številnih epitelijih. MyO10 in tri vrste projekcij, ki temeljijo na aktinu (Philopodes, računi in projekcije, podobne Filopodcem), delajo med metastazami raka.
Invazivne rakave celice imajo veliko število filopod in izražajo visoko stopnjo fascina. Ta protein izvaja preseke med aktinskimi nitkami. Da bi pobegnili iz primarnega tumorja, nastanejo invadiji, bogati s proteolitično aktivnostjo, ki prebavi okolico zunajceličnega matriksa.
Ko celice dosežejo zunajcelični matriks, projekcije, podobne Philopodi, pomagajo razpršiti in kolonizirati. Visoka raven MyO10 kaže na visoko agresivnost in metastaze pri raku dojke.
Myoxovo utišanje povzroči izgubo metastatskega značaja celic, ki ne morejo oblikovati projekcij, ki temeljijo na aktinu. Vse te projekcije imajo adhezije, ki temeljijo na osnovi, ki jih prevaža MY1010 znotraj filopodija.
Myox je vključen v oblikovanje centrov. Odsotnost mioxa daje prednost tvorbi multipolarnih konic. Myox je vključen tudi v signalizacijo v rakavih celicah. Na primer, Myox aktivira 3,4,5, -inositol trifosfat (PIP3).
Reference
- Alberts, b., Johnson, a., Lewis, J., in zelje. 2007. Biologija celične molekularne. Garland Science, New York.
- Brownstein, Z., Abu-Rayyan, a., Karfunkel-don, d., Sirigu, s., Davido, b., Shohat, m., Frydman, m., Houdusse, a., Kanaan, m., Avraham, k. 2014. Nove mutacije miozinov za dedno izgubo sluha, ki jih je razkril ciljni genomski zajem in množično vzporedno zaporedje. Evropski časopis za človeško genetiko, 22: 768 -775.
- Courson, d.S. in Cheney, r.In. 2015. Miozin-x in bolezen. Eksperimentalne raziskave celic, 334: 10-15.
- Lodish, h., Berk, a., Zipurski, s.L., Matsudaria, str., Baltimore, d., Darnell, J. 2003. Celična in molekularna biologija. Uredništvo Medica Panamericana, Buenos Aires, Bogota, Caracas, Madrid, Mehika, Sāo Paulo.
- Schliwa, m. in goohlke, g. 2003. Molekularni motorji. Narava, 422: 759 - 765.
- Vredno.D. 2003. Molekularno orodje za intacelični transport. Cell, 112: 467-480.
- « Značilnosti, strukture in funkcije eksonukleaze
- Zgodovina Bromo, struktura, elektronska konfiguracija, lastnosti, uporabe »

