Fundacija Half Cary Blair, priprava in uporaba
- 2246
- 491
- Miguel Gutmann DVM
On Pol Cary Blair Gre za pol -solidni agar, ki se uporablja za transport in ohranjanje bioloških vzorcev, ki hišijo črevesne patogene, labilne in anaerobne mikroorganizme. Kot vsaka prevozna sredstva je tudi njegova funkcija ohraniti vzorec v optimalnih pogojih, dokler se ne goji. Prisotni patogeni mikroorganizmi in spremljajoča mikrobiota morajo ostati sposobni, vendar brez povečanja populacije.
Mediji Cary Blair so rezultat spremembe v formulaciji prevoza Stuart. Sprememba je bila izvedena leta 1964 in je bila sestavljena iz zamenjave regulativnega sistema PH (gliceofosfata) z anorganiziranim anorganskim pufrom.
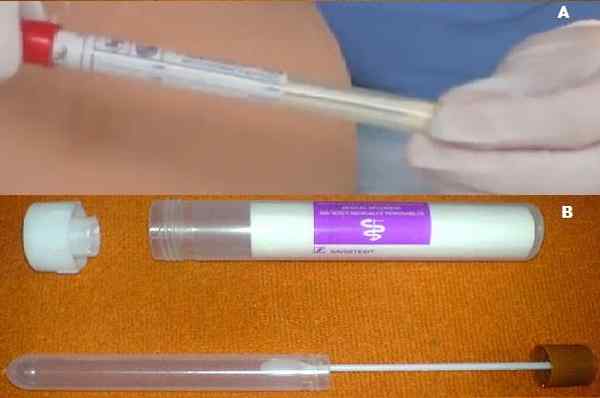
 Do. Kulture s pol Cary Blair B. Kolekcija blata s pol Cary Blair. Vir: a. Video meganhow, pridobite si rano kulturo 2011 youtube.com b. Uporabnik: Mattes [javna domena]
Do. Kulture s pol Cary Blair B. Kolekcija blata s pol Cary Blair. Vir: a. Video meganhow, pridobite si rano kulturo 2011 youtube.com b. Uporabnik: Mattes [javna domena] Preoblikovanje je bilo potrebno, ker so njeni ustvarjalci spoznali, da lahko gliceofosfat čez nekaj časa presnavljajo nekatere saprofitne bakterije. Te, ko pomnožitev prekrivajo sedanje patogene.
Druge spremembe so bile izločanje metilen modre barve, pa tudi prilagoditev pH proti alkalnosti (pH 8,4). Vse te spremembe so izboljšale učinkovitost transportnih sredstev.
Prvotno je bil uporabljen srednji Cary Blair za vzdrževanje črevesnih patogenov, kot so Shigella flexneri, Salmonella sp, Vibrio cholerae in Campylobacter sp.
Vendar je bila pozneje opažena učinkovitost ohranjanja sposobnosti zahtevnih in labilnih patogenih mikroorganizmov, kot so: Neisseria Gonorrhoeae, Haemophilus influenzae, Neisseria meningitidis, Bordetella Ortussis, Streptococcus pneumoniae in nekaj anaerobov.
[TOC]
Osnova
Srednji Cary Blair vsebuje natrijev klorid, natrijev tioglat, disodijev fosfat, kalcijev klorid in agar.
Natrijev klorid vzdržuje osmotsko ravnovesje medija, ravnovesje disodijevega fosfata in kalcijevega klorida. Natrijev tioglical vzdržuje potencial z nizkim oksidom, majhni agarski del.
Vam lahko služi: kje so nastali hominidi?Srednji Cary Blair ne vsebuje prehranskih snovi, saj je funkcija transportnega sredstva vzdrževanje vzorca brez enakih sprememb glede na vlago in mikrobno obremenitev; to pomeni, da se izogne dehidraciji vzorca, ki ohranja sposobnost preživetja in količine prisotnih mikroorganizmov.
Končno se rahlo alkalni pH izogne smrti mikroorganizmov zaradi kislosti, zlasti vibracije so zelo občutljive na kisline.
Priprava
Media Cary Blair lahko komercialno kupite kot posebna naprava, pripravljena za uporabo. Transportni sistem je pokrit s plastiko vrečke za pelice. V notranjosti vsebuje bris za zbiranje vzorca in cev za kontejnerko na pol -solidnem mediju Cary Blair.
Tudi na trgu obstajajo poslovne hiše, ki oskrbujejo dehidrirani medij za pripravo v laboratoriju.
To storiti, kljub 13,2 gr dehidriranega medija in se raztopi v litru destilirane vode. Vroče in pripravljate se, dokler se popolnoma ne raztopite. Medij razdelite v epruvete s pokrovom navoja (Baquelita).
Oddajte cevi za vodno paro za 15 minut. Pustite, da se ohladi in hrani pri sobni temperaturi do uporabe.
Srednji Cary Blair brez inokuliranja se lahko v optimalnih pogojih ohrani do 18 mesecev pri sobni temperaturi.
Srednji pH je treba prilagoditi na 8,4 ± 0,2. Barva pripravljenega medija je bež, z nekaj opalescence.
Uporaba
Vrsta vzorcev
Srednji Cary Blair se uporablja, kadar obstaja nemogoče takoj predelava vzorcev blata, rektalnega in vaginalnega brisa.
Kadar ni mogoče imeti prevoznih sredstev, se vzorci lahko hranijo pri -70 ° C.
Vam lahko služi: primarni limfoidni organiVzorčenje
Bris je impregniran z vzorcem in ga vnesemo v medij Cary Blair, ne da bi dosegel dno.
Identifikacija vzorca
Srednji Cary Blair mora imeti nalepko, v kateri so postavljeni osnovni podatki, na primer: ime in priimek pacienta, identifikacijska številka vzorca, vir vzorca, zdravljenje zdravnika, datum in čas jemanja vzorca, domnevna diagnoza, Zdravljenje z antibiotiki.
Prenos
Dobro pokriva in se prenaša pri sobni temperaturi v primeru vzorcev fekalij. Medtem ko je za vaginalne vzorce v iskanju anaerobnih mikroorganizmov priporočljivo prevoz vzorcev pri 4 ° C.
V vseh primerih je priporočeni čas prenosa 4-6 ur, z največ 24 ur.
Če prisotnost Campylobacter Jejuni V vzorcih blata in jih ni mogoče obdelati v 24 urah, je ohranitev priporočljiva v Half Cary Blair pri 4 ° C.
Preiskave, opravljene na prevozniškem načinu Cary Blair
Več raziskav je pokazalo, da je mogoče srednje Cary Blair ohraniti v enteropatogenih mikroorganizmih rodu Shigella in Salmonella do 49 dni po vzorcu.
S svojim delom, Vibrio kolere, Drug pomemben črevesni patogen je sposoben preživeti 22 dni, medtem ko Yersinia pestis (Vzročno sredstvo bubonske in pnevmonske kuge) je mogoče obnoviti po 75 dneh.
Kljub trajnosti, ki je bila dokazana v zvezi z obnovitvijo teh mikroorganizmov, je priporočljivo, da se vzorci v srednjem Caryju Blair prepeljejo v laboratorij čim hitreje.
Prav tako, ko vzorec doseže laboratorij, ga je treba sejati brez odlašanja pri posameznih pridelkih.
Vam lahko služi: mezothelioPo drugi strani pa je za vzorce, ki vsebujejo anaerobne patogene.
V tem smislu so DeMarco in sodelavci v letu 2017 izvedli študijo z naslovom: Preživetje vaginalnih mikroorganizmov v treh komercialno dostopnih prometnih sistemih.
Dokazali so, da je sredstva Caryja Blaira najboljše prevozno sredstvo za ohranjanje in obnovo vaginalnih anaerobnih mikroorganizmov. Pokazali so tudi, da je bila najvišja stopnja okrevanja dosežena, ko je bila temperatura prenosa 4 ° C.
Zato je ugotovljeno, da je treba temperaturo transporta za vaginalne brise (anaerobni mikroorganizmi) opraviti pri 4 ° C. Medtem ko je za fekalne vzorce v iskanju izbirnih mikroorganizmov, je idealna temperatura okoljska.
QA
Za oceno nadzora kakovosti prevoza Carry Blair, sevi, znani kot Shigella Sonnei ATCC 11060, Salmonella choleraesuis ATCC 14028, Vibrio kolere in Campylobacter sp.
Medij je inokuliran z izbranim sevom in vzdrževan pri sobni temperaturi 24 ur. Potem jih posejajo v ustreznih kulturnih medijih. V vseh primerih se pričakuje zadovoljivo okrevanje zadevnega mikroorganizma.
Reference
- DeMarco AL, Rabe LK, Austin MN et al. Preživetje vaginalnih mikroorganizmov v treh komercialnih sistemih, ki so na voljo. Anaerobe. 2017; 45: 44–49.
- Wasfy m, oyofo b, elgindy a, churilla a. Primerjava povprečja ohranjanja za shranjevanje vzorcev blata. J Clin Microbiol. Devetnajst devetdeset pet; 33 (8): 2176-2178.
- Dan M, Richardson J, miliotis dr., Koornhof HJ. Primerjava konzervacijskih medijev in frezinga za shranjevanje vzorcev iztrebkov. J Med Microbiol. 1989; 28 (2): 151–4.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiološka diagnoza. 5. izd. Pan -ameriški uredništvo s.Do. Argentina.
- Forbes B, Sahm D, Weissfeld a. (2009). Mikrobiološka diagnoza Bailey & Scott. 12 ed. Pan -ameriški uredništvo s.Do. Argentina.
- Conda Laboratories. Pol Cary Blair. Na voljo na: Condalab.com
- Laboratorij Metrix. Cary Blair. Na voljo na: MetrixLab.mx

