Značilnosti lizina, struktura, funkcije, biosinteza
- 958
- 148
- Adrian Legros
The lizin (Lys, K) ali ε-diaminoproična kislina, To je ena od 22 aminokislin.
Drechsel ga je odkril leta 1889 kot produkt hidrolize (razgradnje) kazeinogena. Leta kasneje so Fischer, Siegfried in Hedin ugotovili, da je tudi del beljakovin, kot so želatina, jajčni albumin, konglutin, fibrin in drugi proteini.
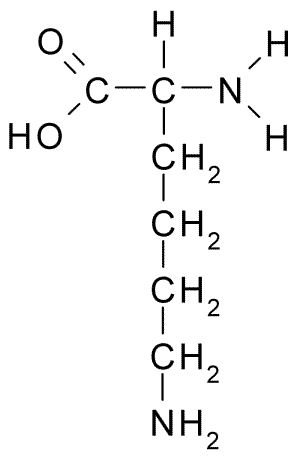
 Kemična struktura aminokislinskega lizina (vir: BORB, prek Wikimedia Commons)
Kemična struktura aminokislinskega lizina (vir: BORB, prek Wikimedia Commons) Njegov pojav je bil nato dokazan v semenskih sadikah v kalitvi in v večini pregledanih rastlinskih beljakovin, ki so določili njihovo številčnost kot splošni sestavni element vseh celičnih beljakovin.
Velja za eno glavnih "omejevalnih" aminokislin v dietah, bogatih z žitami.
Nekatere študije so ugotovile, da vnos lizina daje prednost proizvodnji in sproščanju hormonov insulina in glukagona, kar ima pomembne učinke na telesno energijsko presnovo.
[TOC]
Značilnosti
Lizin je pozitivno obremenjena α-aminokislina.53, kar pomeni, da je fiziološki pH, vaša substituent amino skupina popolnoma ionizirana, podeli pozitivno neto obremenitev aminokislini.
Njegov pojav v beljakovinah različnih vrst živih organizmov je blizu 6%, različni avtorji pa menijo, da je lizin bistven za pravilno rast in popravilo tkiv.
Celice imajo veliko lizinskih derivatov, ki izpolnjujejo veliko raznolikost fizioloških funkcij. V teh so hidroksilizin, metil-lizin in drugi.
Je ketogena aminokislina, kar pomeni, da njegov presnova proizvaja gazirane okostja posredniških substratov za molekule, kot je acetil-CoA, z naknadno tvorbo ketonskih teles v jetrih.
Za razliko od drugih esencialnih aminokislin to ni glikogena aminokislina. Z drugimi besedami, njegova razgradnja se ne konča s proizvodnjo poti posrednikov, ki proizvajajo glukozo.
Struktura
Lizin je razvrščen v skupino osnovnih aminokislin, katerih stranske verige imajo ionizabilne skupine s pozitivnimi obremenitvami.
Skupina stranske verige ali R R ima na atomu ogljika drugo primarno amino skupino v položaju ε njegove alifatske verige, od tod tudi ime "ε-aminocaproico".
Ima atom ogljika α, na katerega se združuje vodikov atom, amino skupino, karboksilno skupino in R stranska veriga R, za katero je značilna molekularna formula (-Ch2-ch2-ch2-ch2-nh3+).
Ker ima stranska veriga tri metilenske skupine, in čeprav ima molekula lizina amino skupino s pozitivnim nabojem do fiziološkega pH Amino skupina.
Amino skupina stranske verige lizin je zelo reaktivna in običajno sodeluje v aktivnih središčih mnogih beljakovin z encimsko aktivnostjo.
Funkcije
Lizin, ki je bistvena aminokislina, izpolnjuje več funkcij, kot so mikrohranil, zlasti pri ljudeh in drugih živalih, vendar je tudi presnovek v različnih organizmih, kot so bakterije, kvasovke, rastline in alge.
Značilnosti njene stranske verige, zlasti značilnosti ε-amino skupine, pritrjene na ogljikovodikovo verigo, ki lahko tvori vodikove mostove, dajejo posebne lastnosti, zaradi katerih sodeluje pri katalitičnih reakcijah pri različnih vrstah encimov.
Lahko vam služi: flora in favna zacatecas: več reprezentativnih vrstJe zelo pomembno za normalno rast in preoblikovanje mišic. Poleg tega gre za molekulo predhodnika za karnitin, spojino, sintetizirano v jetrih, možganih in ledvicah, ki so odgovorni za prevoz maščobnih kislin do mitohondrijev za proizvodnjo energije.
Ta aminokislina je potrebna tudi za tvorbo sinteze in kolagena, pomembnega proteina sistema vezivnega tkiva v človeškem telesu, zato prispeva k vzdrževanju strukture kože in kosti.
Ima eksperimentalno priznane funkcije v:
- Zaščita črevesja pred stresnimi dražljaji, kontaminacijo z bakterijskimi in virusnimi patogeni itd.
- Zmanjšati simptome kronične tesnobe
- Naklonjeni rasti dojenčkov, ki rastejo pod nizko kakovostnimi dietami
Biosinteza
Človeška bitja in drugi sesalci ne morejo sintetizirati aminokislinskega lizina In vivo In zato ga morajo pridobiti od živali in rastlinskih beljakovin, zaužitnih s hrano.
V naravnem svetu sta se za biosintezo lizina razvila dve različni poti: tiste, ki uporabljajo bakterije, rastline in glive "nižje" in drugo, ki jih uporabljajo Euglénides in "Superior" glive.
Lizinska biosinteza v rastlinah, nižjih glivah in bakterijah
V teh organizmih lizin dobimo iz diamineopimelične kisline skozi 7 -korak, ki se začne s piruvatom in pol -etičnim aspartatom. Za bakterije na primer ta pot pomeni proizvodnjo lizina z namenom (1) sinteze beljakovin, (2) sinteze diaminopimelata in sinteze (3) lizina, ki se bo uporabljal v celični steni pepidoglina.
Aspartat v organizmih, ki predstavljajo to pot.
Različna pot v semiiard ASP.
Biosinteza lizin v glivah Superior in Euglénidos
Sinteza lizina od Nove V vrhunskih glivah in euglénid mikroorganizmih se pojavlja prek posrednika L-α-aminoadaadipato, ki se večkrat spreminja na različne načine kot tiste, ki se dogajajo v bakterijah in rastlinah.
Pot je sestavljen iz 8 encimskih korakov, ki vključujejo 7 prostih posrednikov. Prva polovica poti poteka v mitohondrijih in doseže sintezo α-aminoadaadipato. Pretvorba α-aminoadipato v L-lizinu se pojavi pozneje v citosolu.
- Prvi korak poti je sestavljen iz kondenzacije molekul α-ketoglutarata in acetil-CoA z encimsko homohitratno sintazo, ki daje homocitrično kislino.
- Homocitrična kislina se dehidrira v kislini Cis-homoaconitski, ki ga nato pretvori v homoizocitrično kislino z encimom homoaconitasa.
- Homoizocitralna kislina oksidira s homoizocitratno dehidrogenazo, ki dosega prehodno tvorbo oksiglutarata, ki izgubi molekulo ogljikovega dioksida (CO2) in se konča kot α-katadipična kislina.
- To zadnjo spojino prežene s postopkom, odvisnega od glutamata, zahvaljujoč delovanju encima aminotransferaze aminoadapat, ki proizvaja L-α-aminoadipično kislino.
- Stranska veriga L-α-aminoadipične kisline se zmanjša tako.
- Sakaopin reduktaza nato kataliz. Kasneje se imino zmanjša in pridobi sakaopin.
- Končno, ogljikovo-dušikova vez v porcijskem glutamatu sakaopina "reže" encim sakraopin dehidrogenaza, ki se predaja kot končni produkt L-lizin in α-Zetoglutararatna kislina.
Alternative lizinu
Eksperimentalni testi in analize, opravljene s podganami v obdobju rasti, so omogočile razjasnitev, da je ε-N-Acetil-lizin lahko nadomesti lizin za podporo rasti mladih in to zahvaljujoč prisotnosti encima: ε-lizin acilaza.
Lahko vam služi: Affettic Zone: Značilnosti, flora, favnaTa encim katalizira hidrolizo ε-N-acetil-lizin za proizvodnjo lizina in to počne hitro in v obilnih količinah.
Degradacija
Pri vseh vrstah sesalcev prvi korak v razgradnji lizina katalizira z lizin-2-oksoglutaratnim encim reduktaza, ki je sposobna pretvoriti lizin in α-oksoglutarat v sakalopin, aminokislinski derivat, ki je bil prisoten v živalskih fizioloških tekočinah in čigar obstoj v njih je bilo demonstrirano in čigar obstoj v njih je bilo demonstrira v poznih 60. letih.
Sakroopin se vrne na α-aminoadipato Δ-semialdehid in glutamat z delovanjem encimske sakaropin dehidrogenaze. Drug encim je sposoben uporabiti tudi Sacaropino kot substrat za hidroliz.
Sakaropin, eden glavnih presnovnih posrednikov pri razgradnji lizina, ima nadomestno hitrost, v fizioloških pogojih, izjemno visok, zato se ne kopiči v tekočinah ali tkivih, kar je dokazano z visokimi dejavnostmi, ki jih najdemo pri razvijalcu dehidrogenaza.
Vendar pa je količina in aktivnost encimov, ki sodelujejo pri presnovi lizina.
"Sacaropinuria"
Obstaja patološko stanje, povezano z veliko izgubo aminokislin, kot so lizin, citrulin in histidin z urinom, in to je znano kot "saropinurija". Sakaropin je aminokislinski derivat presnove lizina, ki se izloča skupaj s tremi aminokislinami, omenjenimi v urinu "saropinuričnih".
Sakaropin je bil sprva odkrit v pivskem kvasu in je predhodnik lizina v teh mikroorganizmih. V drugih evkariontskih organizmih se ta spojina proizvaja med razgradnjo lizina v mitohondrijih hepatocitov
Živila, bogata z lizinom
Lizin dobimo iz hrane, ki jo zaužijemo s prehrano, in povprečno odraslo osebo potrebuje vsaj 0.8 g tega dne. Najdemo ga v številnih beljakovinah živalskega izvora, zlasti v rdečem mesu, kot so krava, jagnjetina in piščanec.
Je v ribah, kot so tuna in losos, in v sadju morja, kot so ostrige, kozice in školjke. Prisoten je tudi v sestavnih beljakovinah mlečnih izdelkov in njihovih derivatov.
V rastlinski hrani najdemo v krompirju, v papriki in v por. Je tudi v avokadu, breskvah in hruškah. V stročnicah, kot so arriñonados fižol, čičerika in soja; v bučnih semenah, v oreščkih Macadamije in v Anacardu (Merey, Marañón itd.).
Prednosti vašega vnosa
Ta aminokislina je vključena v številna zdravila za prehransko formulacijo, torej izolirano iz naravnih spojin, zlasti rastlin.
Uporablja se kot antikonvulziven, njegova učinkovitost pa je bila dokazana tudi pri zaviranju podvajanja Virus herpes simpleksa Tip 1 (HSV-1), ki se običajno kaže v stresnih trenutkih, ko je imunski sistem pritisnjen ali "oslabljen" kot ampule ali herpes na ustnicah.
Učinkovitost dodatkov L-lizin za zdravljenje herpesa ustnic je posledica dejstva, da ta "tekmuje" ali "blokira" arginin, drugo beljakovinsko aminokislino, kar je potrebno za množenje HSV-1.
Ugotovljeno je bilo, da ima lizin tudi antiansoulitske učinke, saj pomaga blokirati receptorje, ki sodelujejo pri odzivih na različne stresne dražljaje, poleg sodelovanja pri znižanju ravni kortizola, "stresnega hormona".
Nekatere študije so pokazale, da je lahko koristno za inhibicijo rakotvornih tumorjev, za zdravje oči, za nadzor krvnega tlaka.
Vam lahko služi: kulturni mediji: zgodovina, funkcija, vrste, pripravaPri živalih
Skupna strategija za zdravljenje okužb z virusom herpesa I v mačjih malih je dopolnitev lizina. Vendar nekatere znanstvene publikacije ugotavljajo, da ta aminokislina v mačjih nima nobene protivirusne lastnine, temveč deluje z zmanjšanjem koncentracije arginina.
V zdravje dojenčkov
Eksperimentalni vnos L-lizine, dodan v dojenčku v mleku v obdobju dojenja, se je izkazal za korist za pridobitev telesne mase in indukcije apetita pri otrocih v prvih fazah poporodnega razvoja.
Vendar lahko presežek L-lizina povzroči pretirane izločitve urinskih aminokislin, tako nevtralnih kot osnovnih lastnosti, kar ima za posledico njihovo neravnovesje telesa.
Presežek dopolnjevanja L-lizina se lahko konča pri zatiranju rasti in drugih histoloških učinkov očitnih v pomembnih organih, verjetno zaradi izgube aminokislin z urinom.
V isti študiji je bilo tudi dokazano, da dopolnjevanje lizina izboljša prehranske lastnosti, ki jih zaužijejo rastlinske beljakovine.
Druge podobne študije, ki so jih izvedli pri odraslih in otrocih obeh spolov v Gani, Siriji in Bangladešu, so pokazale koristne lastnosti vnosa lizina za zmanjšanje driske pri otrocih in nekaterih smrtnih dihalnih razmer pri odraslih moških pri moških pri moških.
Motnje pomanjkanja lizina
Lizin je, tako kot vse bistvene in nepomembne aminokisline, potreben za pravilno sintezo celičnih beljakovin, ki prispevajo k tvorbi telesnih organskih sistemov.
Označene pomanjkljivosti lizina v prehrani, saj gre za bistveno aminokislino, ki je ne proizvaja telo, lahko povzroči razvoj tesnobnih slik, ki jih posreduje serotonin, poleg driske, povezanih tudi s serotoninskimi receptorji.
Reference
- Skleda, s., & Bunnik in. M. (2015). Prodaja lizina ni učinkovita za preprečevanje ali zdravljenje okužbe z mačjim herpesvirusom 1 pri mačkah: sistematičen pregled. Veterinarske raziskave BMC, enajst(1).
- Carson, n., SCALY, b., Neill, d., & Carré, jaz. (1968). Saccharopinuria: nova prirojena napaka metabolizma lizina. Narava, 218, 679.
- Colina R, J., Díaz e, m., Manzanilla M, L., Araque m, h., Martínez G, g., Rossini V, m., & Jerez-Timaure, n. (2015). Vrednotenje prebavljive ravni lizina v prehrani z visoko energijsko gostoto za končne prašiče. Revija MVZ Córdoba, dvajset(2), 4522.
- Štipendisti, b. F. C. Yo., & Lewis, m. H. R. (1973). Presnova lizina pri sesalcih. Journal Biochemical, 136, 329-334.
- Fornazier, r. F., Azevedo, r. Do., Ferreira, r. R., & Varisi, v. Do. (2003). Katabolizem lizina: pretok, presnovna vloga in regulacija. Brazilski časopis za rastlinsko fiziologijo, petnajst(1), 9-18.
- Ghosh, s., Smriga, m., Vuvor, f., Suri, d., Mohammed, h., Armah, s. M., & Scrimshaw, n. S. (2010). Vpliv prošnje lizine na zdravje in obolevnost pri osebah, ki pripadajo revnim obmejnim gospodinjstvom v Accra, Gana. American Journal of Clinical Nutrition, 92(4), 928–939.
- Hutton, c. Do., Perugini, m. Do., & Gerrard, J. Do. (2007). Inhibicija biosinteze lizina: razvijajoča se strategija antibiotikov. Molekularni biosistemi, 3(7), 458–465.
- Kalogeropoul, d., Lafave, l., Schweim, k., Gannon, m. C., & Nuttall, f. Q. (2009). Zaužitje lizina izrazito zmanjša odziv glukoze na zaužito glukozo brez spremembe inzulinskega odziva. American Journal of Clinical Nutrition, 90(2), 314–320.
- Nagai, h., & Takeshita, s. (1961). Prehranski učinek dopolnjevanja L-lizina na rast dojenčkov in otrok. Japonska pediatrija, 4(8), 40–46.
- O'Brien, s. (2018). Zdravstvena linija. Pridobljeno 4. septembra 2019 z www.Zdravstvena linija.com/prehrana/lizin-benefits
- Zabriskie, t. M., & Jackson, m. D. (2000). Lizinska biosinteza in presnova v glivah. Poročila o naravnih izdelkih, 17(1), 85–97.

