Zakon formule in enot idealnih plinov, aplikacij, primeri

- 918
- 222
- Lee Farrell
The Idealen zakon o plini Gre za državno enačbo, ki opisuje razmerje med državnimi funkcijami, povezanimi z idealnim plinom; kot so temperatura, tlak, prostornina in moli. Ta zakon omogoča preučevanje resničnih plinastih sistemov, ki jih primerjajo z njihovimi idealiziranimi različicami.
Idealen plin je teoretični plin, sestavljen iz specifičnih ali sferičnih delcev, ki se premikajo naključno; Z veliko kinetično energijo, kjer so edina interakcija med njimi popolnoma elastična spopada. Poleg tega so v skladu z idealnim zakonom o plinu.
 Zakon o idealnem plinu omogoča preučevanje in razumevanje številnih resničnih plinastih sistemov. Vir: pxhere.
Zakon o idealnem plinu omogoča preučevanje in razumevanje številnih resničnih plinastih sistemov. Vir: pxhere. Pri standardnem tlaku in temperaturi (STP): 1 atm tlaka in temperatura 0 ° C se večina resničnih plinov kakovostno obnaša kot idealni plini; pod pogojem, da so njihove gostote nizke. Velike medmolekularne ali interatomske razdalje (za plemenite pline) olajšajo takšne pristope.
V pogojih STP kisik, dušik, vodik, plemenit plini in nekateri sestavljeni plini, kot je ogljikov dioksid, se obnašajo kot idealen plin.
Idealen model plina ponavadi ne uspeva pri nizkih temperaturah, visokih tlakih in gostotah z visokimi delci; Ko medmolekularne interakcije in velikost delcev postanejo pomembni.
Zakon o idealnih plinih je sestava treh zakonov o gasiji: zakon Boyle in Mariotte, zakon Charlesa in Gay-Lussac ter Avogadro's Law.
[TOC]
Formula in enote

Zakon plinov se matematično izraža s formulo:
Pv = nrt
Kjer je p tlak, ki ga izvaja plin. Običajno se izraža z atmosfero (ATM), čeprav se lahko izrazi v drugih enotah: MMHG, Pascal, Bar itd.
Zvezek V, ki ga zaseda plin, se običajno izraža z enotnostjo litra (l). Medtem n To je število molov, r univerzalna konstanta plinov in t temperatura, izražena v Kelvinu (K).
Najbolj uporabljen izraz v R plinovih je enakovreden 0,08206 l · atm · k-1· Mol-1. Čeprav ima enota za plinsko konstanto vrednost 8.3145 j · mol-1· K-1. Oba veljata, dokler sta previdna z enotami drugih spremenljivk (P, T in V).
Zakon o idealnih plinih je kombinacija zakona Boyle-Maleotte, zakona Charlesa-Gay-Lussac in zakona Avogadro.
Zakon Boyle-Maleotte
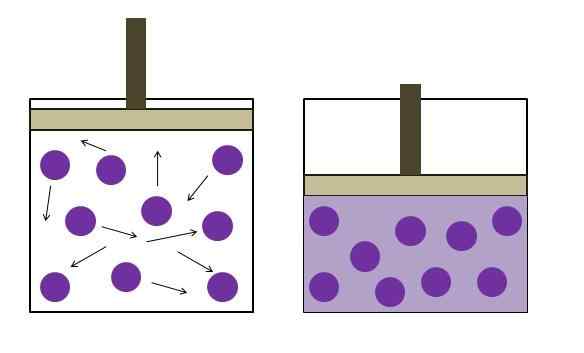 Povečan tlak znižanja tlaka. Vir: Gabriel Bolívar
Povečan tlak znižanja tlaka. Vir: Gabriel Bolívar Samostojno ga je oblikoval fizik Robert Boyle (1662) in fizični in botanik Edme Mariotte (1676). Zakon je naveden na naslednji način: pri konstantni temperaturi je prostornina fiksne mase plina obratno sorazmerna s pritiskom, ki ga izvaja.
Vam lahko služi: terpenosPV ∝ K
Z uporabo dveh točk:
Str1V1 = P2V2
Zakon Charles-Gay-Lussac
 Kitajske luči ali želje. Vir: pxhere.
Kitajske luči ali želje. Vir: pxhere. Zakon je leta 1803 objavil Gay-Lussac, vendar se je skliceval na delo, ki ga ni objavil Jacques Charles (1787). Zaradi tega je zakon znan kot Charlesov zakon.
Zakon določa, da je pri stalnem tlaku neposredno razmerje sorazmernosti med prostornino, ki ga zaseda plin, in njeno temperaturo.
V ∝ k2T
Z uporabo dveh točk:
V1/T1 = V2/T2
V1T2 = V2T1
Avogadro zakon
Zakon je leta 1811 navedel Amadeo Avogadro, pri čemer je poudaril, da imajo enaki količini vseh plinov pri istem tlaku in temperaturi enako število molekul.
V1/n1 = V2/n2
Kaj vzpostavlja zakon o idealnih plinih?
Z zakonom o idealnih plinih se vzpostavi razmerje med štirimi neodvisnimi fizikalnimi lastnostmi plina: tlak, prostornina, temperatura in količina plina. Dovolj je, da poznamo vrednost treh, da dobimo preostalo.
Zakon določa pogoje, ki kažejo, kdaj se plin v idealnem primeru obnaša, in kdaj se oddalji od tega vedenja.
Na primer, tako imenovani kompresijski faktor (PV/NRT) ima vrednost 1 za idealne pline. Vrednost vrednosti 1 za faktor stiskanja kaže, da se vedenje plina oddaljuje od idealnega plina.
Zato bi bila napaka pri uporabi enačbe idealnih plinov na plin, ki se ne obnaša po modelu.
Prijave
Izračun gostote in molarne mase plina
Enačba zakona o idealnem plinu se lahko uporabi pri izračunu gostote plina in njegove molarne mase. Pri preprosti spremembi lahko najdete matematični izraz, ki povezuje gostoto (d) plina in njegove molarne mase (m):
D = MP/RT
In čiščenje m:
M = DRT/P
Izračun prostornine plina, proizvedenega v kemični reakciji
Stoihiometrija je veja kemije, ki povezuje količino vsakega od reagentov, ki so prisotni z izdelki, ki sodelujejo v kemični reakciji, običajno izražene v molih.
Uporaba enačbe idealnih plinov omogoča določanje volumna plina, ki nastane v kemični reakciji; Ker lahko iz kemične reakcije dobite število molov. Nato lahko izračunamo prostornino plina:
Vam lahko postreže: stekleni ionomer: priprava, lastnosti, vrste, uporabePv = nrt
V = nrt/p
Merjenje v lahko določi uspešnost ali napredek omenjene reakcije. Kadar ni več plinov, je kazalo, da so se reagenti popolnoma izčrpali.
Izračun delnih tlakov plinov, prisotnih v mešanici
Za zakon o delnih pritiskih v Daltonu se lahko uporabi zakon o idealnih plinih za izračun delnih tlakov različnih plinov, ki so prisotni v plinski mešanici.
Razmerje je uporabljeno:
P = nrt/v
Najti tlak vsakega od plinov v mešanici.
Količina plina, zbranega v vodi
Izdelana je reakcija, ki proizvaja plin, ki ga zbira eksperimentalna zasnova v vodi. Skupni tlak plina je znan plus tlak vodne pare. Vrednost slednjega lahko dobite v tabeli in s odštevanjem plina lahko izračunamo.
Iz stehiometrije kemične reakcije lahko dobimo število molov plina in uporabimo razmerje:
V = nrt/p
Izračuna se prostornina proizvedenega plina.
Primeri izračunov
Vaja 1
Plin ima gostoto 0,0847 g/L do 17 ° C in tlak 760 Torr. Kaj je tvoja molarna masa? Kaj je plin?
Začnemo iz enačbe
M = DRT/P
Najprej pretvorimo temperaturne enote v Kelvin:
T = 17 ° C + 273,15 K = 290,15 K
In tlak 760 Torr ustreza tlaku 1 atm. Zdaj morate zamenjati le vrednosti in rešiti:
M = (0,0847 g/l) (0,08206 L · ATM · K-1· Mol-1) (290,15 K) / 1 atm
M = 2.016 g/mol
Ta molarna masa lahko ustreza eni vrsti: diatomska molekula vodika, H2.
Vaja 2
Masa 0,00553 g živega srebra (HG) v plinski fazi je v prostornini 520 L in pri temperaturi 507 K. Izračunajte tlak, ki ga izvaja HG. Molarna masa Hg je 200,59 g/mol.
Težava se reši z uporabo enačbe:
Pv = nrt
Informacije o številu molov HG se ne pojavljajo; Lahko pa jih dobimo z uporabo njihove molarne mase:
Moli Hg = (0,00553 g Hg) (1 mol Hg/200,59 g)
Vam lahko služi: kisik: lastnosti, struktura, tveganja, uporabe= 2.757 · 10-5 Moli
Zdaj moramo počistiti P in zamenjati vrednosti:
P = nrt/v
= (2.757 · 10-5 moli) (8,206 · 10-2 L · atm · k-1· Mol-1) (507 K)/ 520 l
= 2.2 · 10-6 Bankomat
Vaja 3
Izračunajte tlak, ustvarjen s klorovodikovo kislino, ki nastane z reakcijo 4,8 g klora (CL2) z vodikovim plinom (h2), V prostornini 5,25 L in pri temperaturi 310 K. Molarna masa Cl2 je 70,9 g/mol.
H2 g) + Cl2 g) → 2 HCl(g)
Težava se reši z uporabo enačbe idealnih plinov. Toda količina HCl je izražena v gramih in ne v molih, zato je ustrezna preobrazba izvedena.
Moli HCl = (4,8 g Cl2) (1 mol Cl2/70,9 g Cl2) (2 mol HCl/1Mol Cl2)
= 0,135 molov HCl
Uporaba enačbe zakona o idealnih plinih:
Pv = nrt
P = nrt/v
= (0,135 molov HCl) (0,08206 L · ATM · K-1· Mol-1) (310 K) / 5.25 l
= 0,65 atm
Vaja 4
Vzorec 0,130 g plinaste spojine zavzema volumen 140 ml pri temperaturi 70 ° C in pri tlaku 720 Torr. Kaj je tvoja molarna masa?
Če želite uporabiti idealno enačbo Gase, je treba najprej narediti več sprememb:
V = (140 ml) (1 L/1000 ml)
= 0,14 l
Če imate prostornino v litrih, morate v Kelvinu izraziti temperaturo:
T = 70 ° C + 273,15 K = 243,15 K
In končno moramo pritisk spremeniti v atmosfere:
P = (720 Torr) (1 atm/760 Torr)
= 0,947 atm
Prvi korak pri reševanju problema je pridobiti število molov iz spojine. Za to se uporablja enačba idealnih plinov in smo se očistili n:
Pv = nrt
N = PV / RT
= (0,947 atm) (0,14 l) / (0,08206 L · atm · K-1· Mol-1) (243,15 K)
= 0,067 molov
Molsko testo je treba izračunati le z deljenjem gramov med pridobljene mole:
Molarna masa = grami spojine / števila molov.
= 0,130 g / 0,067 molov
= 19,49 g/mol
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Iran. Levine. (2014). Načela fizikalnokemije. Šesta izdaja. MC Graw Hill.
- Glasstone. (1970). Pogodba o fizikalni kemiji. Druga izdaja. Aguilar.
- Mathews, c. K., Van Holde, k. In., In ahern, k. G. (2002). Biokemija. 3je bil Izdaja. Uredništvo Pearson Addison Wesley.
- Wikipedija. (2019). Idealen plin. Pridobljeno iz: v.Wikipedija.org
- Uredništvo. (2018). Boyle Law ali Boyle-Maleotte Law | Plinski zakoni. Okreval od: iquimicas.com
- Jessie a. Ključ. (s.F.). Idealni zakon o plinu in podnebje. Pridobljeno iz: OpenTextbc.AC

