Hess Pojasnilo zakon, aplikacije, primeri
- 842
- 100
- Ricky Dach
The Hess zakon To je še ena manifestacija zakona o ohranjanju energije, ki omogoča določitev s preprostimi algebrskimi vsotami entalpijo kemijske reakcije. Entalpija, ki se razume kot toplota, ki se sprošča ali absorbira, pri konstantnem tlaku, kar je povezano s kakršno koli kemijsko reakcijo ali kemičnim pojavom.
Entalpije, ΔH, se eksperimentalno določijo z uporabo kalorimetrije. Vendar obstajajo reakcije, ki jih je težko preučiti s to tehniko. Ko se to zgodi, se uporabljajo tudi druge reakcije, ki jih imajo njihove posebne entalpije in imajo interese ali spojine, ki zanimajo.
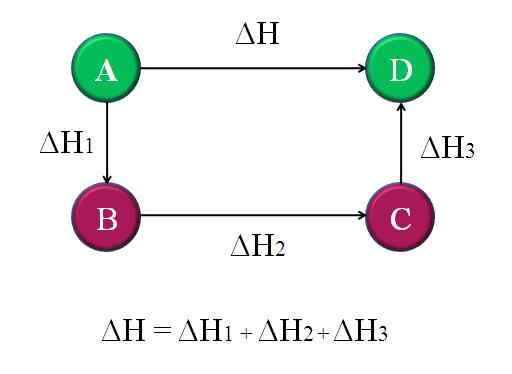
 Preprost in splošen diagram, kjer se uporablja zakon Hess za štiri kemijske reakcije. Vir: Gabriel Bolívar.
Preprost in splošen diagram, kjer se uporablja zakon Hess za štiri kemijske reakcije. Vir: Gabriel Bolívar. Na ta način je mogoče izračunati "neznani" ΔH reakcije. Na primer, zgornji diagram pomaga razumeti to idejo. Obstajajo štiri reakcije: A-D, A-B, B-C in C-D. Reakcija A-D je tista, ki ima največji ΔH, ker se tako rekoč pojavljajo, najbolj razvpita kemične spremembe.
Druge reakcije imajo manjše ΔH, saj so sestavljene iz alternativnih korakov ali nadomestnih reakcij, da dosežejo iste produkte d. Zato vsota ΔH1, ΔH2 in ΔH3, Enako bo ΔH. Če to poznate, je mogoče izračunati ΔH ali katero koli drugo entalpijo z uporabo preprostih jaslic. To je Hessov zakon.
Hessov zakon je zelo koristen pri izračunu reakcijskih entalpij, pa tudi entalpije za različne spojine ali nestabilne posrednike.
[TOC]
Pojasnilo Hessovega zakona
Izračun entalpije reakcije
Razlog, zakaj se izpolni:
ΔH = ΔH1 + ΔH2 + ΔH3
To je zato, ker je entalpija ali sprememba entalpije stavna funkcija. To pomeni, da njihove vrednosti niso spremenjene s številom korakov, stopenj ali posrednikov. Na primer, ΔH bo ostal enak, tudi če obstaja ΔH10 to je treba upoštevati v algebrski vsoti.
Entalpije bi lahko vizualizirali kot vrhovi nekaterih gora. Ne glede na to, kako so usmerjeni koraki do njih, višina, ki jih loči od ravni MAR. In natančno je višine, ki se dodajo ali odštejejo za določitev neznane višine okoliške gore.
Vrnitev na prejšnji diagram: a, to je gora, druge gore ipd. Razlika v višini med A in D vrhovi je največja. Če dodate višine med A-B, B-C in C-D, bo dalo enako višini A-D. To je tisto, kar se naredi z entalpijami njihovih kemijskih reakcij.
Vam lahko služi: fosfatna skupinaEntalpija reakcije iz entalpije formacij
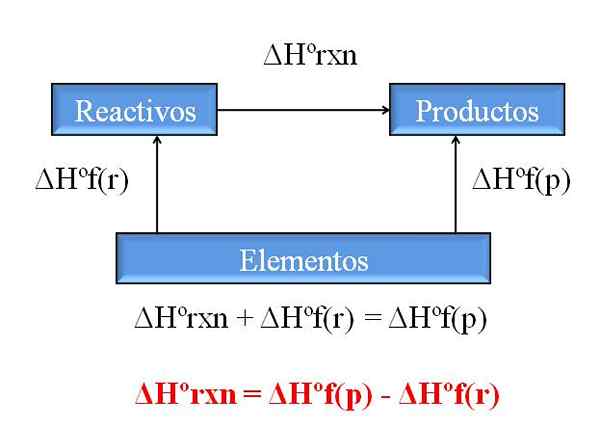 Splošni diagram za izračun entalpije reakcije iz entalpije formacij. Vir: Gabriel Bolívar.
Splošni diagram za izračun entalpije reakcije iz entalpije formacij. Vir: Gabriel Bolívar. Ena najdragocenejših posledic Hessovega zakona je, da omogoča določanje entalpij kakršne koli kemijske reakcije, pri čemer vzame entalpije vseh spojin (reagentov in izdelkov).
Vrhunska slika ponazarja to točko. Razumemo z entalpijo povezane nastajanja toplote, ko se iz njenih elementov oblikuje spojina. Ta entalpija bi postala največja možna razlika med reagenti in izdelki, ne da bi se morali posvetovati z drugimi kemičnimi reakcijami; Vsaj zunaj ločenega treninga spojin.
Kako tokrat preberete diagram? Trik je vedno dodati entalpije, ko gre v smeri puščice, in jih odštejte, ko je puščica na nasprotni poti. Tako ΔHºrxn, standardna reakcijska entalpija, dodaja ΔHºF (reagenti), standardno entalpijo tvorbe reagentov in jih odštejemo ΔHºF (izdelki), standardna entalpija tvorbe izdelkov izdelkov.
Reakcije vsote
Diagrami lahko postanejo zelo zapleteni za razlago, še posebej, kadar je veliko reakcij, ki jih je treba upoštevati. Zato se uporablja vsota reakcij. Ta metoda močno olajša izračun entalpij in pospeši razumevanje Hessovega zakona.
Recimo na primer, da želite določiti ΔHºrxn naslednje reakcije:
A + B + C → ABC
In imamo tudi še dve reakciji:
A + B → AB (ΔHº1)
AB + C → ABC (ΔHº2)
Zanimivo je, da so A + B + C na levi strani (reagenti) in da je ABC na desni strani (izdelki). Nato preprosto nadaljujemo z dodajanjem zadnjih dveh reakcij:
A + B → AB
AB + C → ABC
A + AB + C → ABC + AB
Ker je AB z obeh strani, je odpravljen. In tako imamo:
A + B + C → ABC
ΔHºrxn = ΔHº1 + ΔHº2
Če dodate reakcije, je uporaba katerega koli diagrama izpuščena.
Prijave Hessovega zakona
Hessov zakon omogoča, da brez potrebe po poskusih, entalpijah za različne kemijske reakcije ali pojave. Nekateri od njih so navedeni:
- Usposabljanje entalpije za nestabilne spojine ali posrednike, kot jih običajno imamo v organski kemiji.
-Entalpije faznih prehodov v preučevanju kristalnih trdnih snovi.
Vam lahko služi: kemična spojina-Entalpije alotropnih prehodov, kot sta tista med grafitom in diamantom.
Prav tako se Hessov zakon uporablja za določanje retikularne energije trdne snovi in elektronskih afinitet nekaterih atomov.
Primeri: rešene vaje
- Primer 1
Izračunajte ΔHRXN naslednje reakcije:
2HCl (g) + f2(g) → 2HF (L) + Cl2(g)
Če imate naslednje reakcije in njihove entalpije:
4HCl (g) + oz2(g) → 2H2Ali (l) + 2cl2(g) (ΔH = -202.4 kJ/mol)
1/2H2(g) + 1/2f2(g) → hf (l) (ΔH = -600.0 kJ/mol)
H2(g) + 1/2o2(g) → h2Ali (l) (ΔH = -285.8 kJ/mol)
Naročanje enačb
Za začetek moramo dodati reakcije tako, da HCl in F2 so na levi strani, HF in Cl2, Na desni strani. Toda še pomembneje je, da opazimo, da toliko h2 kot h2Ali niso v enačbi obresti. Zato jih moramo preklicati v znesku in narediti, da stehiometrični koeficienti sovpadajo z množenjem:
2HCl (g) + 1/22(g) → h2Ali (l) + cl2(g) (ΔH = -202.4 kJ/mol) * (1/2)
Ta enačba je bila pomnožena z 1/2, da bi imela 2HCl namesto 4HCl
H2(g) + f2(g) → 2HF (l) (ΔH = -600.0 kJ/mol) * (2)
Ta enačba se je pomnožila z 2, da ima F2 in ne 1/2f2
H2Ali (l) → h2(g) + 1/2o2(g) (ΔH = -285.8 kJ/mol) * (-1)
Medtem se je slednji pomnožil z -1, da bi ga "obrnil". Tako imamo urejene enačbe in pripravljeni dodati.
Vsota enačb
Če dodamo vse, nam daje:
2HCl (g) + 1/22(g) → h2Ali (l) + cl2(g) (ΔH = -101.2 kJ/mol)
H2(g) + f2(g) → 2HF (L) ΔH = -1200.0 kJ/mol)
H2Ali (l) → h2(g) + 1/2o2(g) (ΔH = 285.8 kJ/mol)
2HCl (g) + f2(g) → 2HF (L) +Cl2(g)
Upoštevajte, da pogoji 1/22, H2Ali in h2 Odpovedani so, ker so na obeh straneh puščice. Dodane so tudi entalpije, ki dajejo:
ΔHRX = 285.8 kJ/mol + (-101.2 kJ/mol) + (-1200.0 kJ/mol)
Ta izraz je enak začetku:
ΔH = ΔH1 + ΔH2 + ΔH3
In tako imamo, da je ΔHRX enak:
ΔHRX = -1015.4 kJ/mol
- Primer 2
V tem primeru bo razvidno, da entalpije nadomestnih reakcij ustrezajo entalpijam tvorbe interesnih spojin.
Za naslednjo reakcijo razgradnje je želeti določiti ΔHRXN:
2SO3(g) → 2SO2(g) + oz2(g)
In trening entalpije SO spojin se šteje na roki3 In tako2:
S (s) + o2(g) → Torej2(g) (ΔH = -296.8 kJ/mol)
Vam lahko služi: izopreno: struktura, lastnosti, aplikacijeS (s) + 3/2o2(g) → Torej3(g) (ΔH = -395.6 kJ/mol)
Naročanje enačb
Ta vaja bo rešena na enak način kot prejšnji primer. To bi moralo biti tako3 biti prav in pomnožite z 2. Za to moramo "obrniti" enačbo formacije SO3 Pomnožimo ga za -1 in nato pomnožimo z 2:
2SO3(g) → 2s (s) + 3o2(g) (ΔH = -395.6 kJ/mol) * (-2)
Enačba tvorbe SO2 Pomnožimo ga tudi z 2:
2s (s) + 22(g) → 2SO2(g) (ΔH = -296.8 kJ/mol) * (2)
Vsota enačb
Zdaj so dodane enačbe:
2SO3(g) → 2s (s) + 3o2(g) (ΔH = 791.2 kJ/mol)
2s (s) + 22(g) → 2SO2(g) (ΔH = -593.6 kJ/mol)
2SO3(g) → 2SO2(g) + oz2(g)
Upoštevajte, da je izraz 2s odpravljen, ker je na obeh straneh puščice. Tudi 32 2o se odšteje2 dati o2. Vsota entalpij in zato bo vrednost ΔHRXN:
ΔH = ΔHrxn = 791.2 kJ/mol + (-593.6 kJ/mol)
= 197.6 kJ/mol
Kot vsaka reakcija razgradnje je tudi endotermična, zato je njegova entalpija pozitivna.
Alternativna metoda
Obstaja metoda, s katero lahko dosežemo ta isti rezultat na bolj neposreden in preprost način. To je bilo omenjeno v prejšnjem razdelku.
2SO3(g) → 2SO2(g) + oz2(g)
Za določitev ΔHRXN te reakcije moramo izračunati ΔHºF (reagenti) in ΔHºF (produkti). ΔHºF (tako3) je enak -395.6 kJ/mol, medtem ko je ΔHºF (tako2) je enak -296.8 kJ/mol. ΔHºF (ali2) je enak 0, saj elementarni kisik obstaja kot molekula O2 in ne kot atomi ali prosti.
Torej, imamo:
ΔHRXN = ΔHºF (izdelki) - ΔHºF (reagenti)
= [ΔHºF (torej2) + ΔHºF (ali2)] - ΔHºF (tako3)
= ΔHºF (torej2) - ΔHºF (tako3)
Vendar moramo pomnožiti obe entalpiji za 2, da se ujemamo s stehiometričnimi koeficienti glede na kemijsko enačbo:
ΔHrxn = 2ΔHºf (tako2) - 2ΔHºF (tako3)
In izračunavamo:
ΔHrxn = 2 (-296.8 kJ/mol) - 2 (-395.6 kJ/mol)
= 197.6 kJ/mol
Pravzaprav je to tako, kot je običajno raje razrešiti vse vaje, v katerih se uporablja zakon o HESS.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Wikipedija. (2020). Hessov zakon. Pridobljeno iz: v.Wikipedija.org
- Cohen Shelly. (18. maja 2020). Hessov zakon. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Clark Jim. (2010). Hessovi izračuni sprememb in entalpije. Okrevano od: Chemguide.co.Združeno kraljestvo
- Čelada, Anne Marie, ph.D. (11. februar 2020). Hessova zakonska definicija. Okreval od: Thoughtco.com
- Foist Laura. (2020). Hessov zakon: definicija, formula in primer. Študij. Okrevano od: študij.com
- Quimitube. (2014). Teorija 14 Termokemija: Izračun entalpije reakcije Hessovega zakona. Okreval od: quimitube.com
- « Napetostni test Kako je, lastnosti, primeri
- Preskus stiskanja, kako se izvaja, lastnosti, primeri »

