LDH funkcije, določitev, reakcija, normalne vrednosti
- 2520
- 492
- Ignacio Barrows
The laktat dehidrogenaza, Laktična kislina dehidrogenaza, laktat odvisna od DENBELIA ali preprosto LDH, je encim, ki pripada skupini oksidortikas.
Encimi te vrste so označeni s številko 1.1.1.27 odbora za encimsko nomenklaturo in so odgovorni za reakcijo, ki pretvori laktat v piruvat (z oksidacijo) in obratno (z redukcijo), oksidacijo ali zmanjšanje diukleotidov adenin nikotinamida (NAD+ in NADH) v procesu, znanem kot laktična fermentacija.
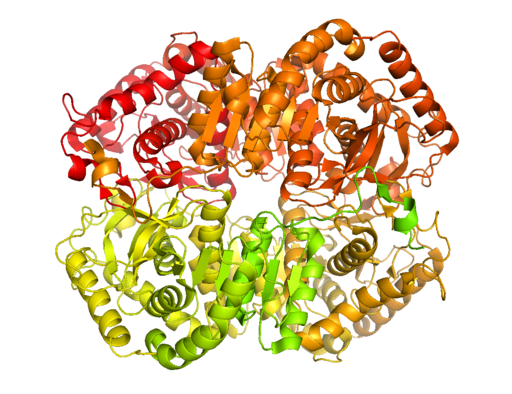
 Kristalna struktura laktat dehidrogenaze B (vir: Bcdoye [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] prek Wikimedia Commons)
Kristalna struktura laktat dehidrogenaze B (vir: Bcdoye [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)] prek Wikimedia Commons) Za razliko od alkoholne fermentacije, ki se pojavlja le v nekaterih mikroorganizmih, kot so kvasovke in uporaba.
Ta pomemben encim za presnovo celic je bil v 40. letih prejšnjega stoletja kristaliziran iz mišic skeletnih podgan, do danes pa so najbolje značilne skeletne mišice in srčno tkivo pri sesalcih.
Pri "nadrejenih" živalih encim uporablja laktatni L izomer (L-laktat) za proizvodnjo piruvata, vendar nekatere "nižje" živali in bakterije proizvajajo d-laktat iz piruvata, pridobljenega z glikolizo.
Laktat dehidrogenaza se običajno izraža večinoma v tkivih ali celicah v anaerobnih pogojih (nizko namakanje krvi), ki lahko na primer pri ljudeh označijo patološka stanja, kot so rak, jetra ali srčni pogoji.
Vendar je pretvorba piruvata v laktat značilna za mišice med vadbo in roženico očesa, ki je slabo oksigenirana.
[TOC]
Funkcije
Laktat dehidrogenaza izpolnjuje več funkcij na številnih presnovnih poteh. To je središče občutljivega ravnovesja med kataboličnimi in anaboličnimi potmi ogljikovih hidratov.
Med aerobno glikolizo piruvat (zadnji produkt poti po sebi) Uporablja se lahko kot substrat encimske kompleksne piruvat dehidrogenaze, s katero je dekarboksilirana, sprošča molekule acetil-CoA, ki se uporabljajo navzdol, presnovno, v ciklu Krebs.
V anaerobni glikolizi nasprotno zadnji korak glikolize povzroči piruvat, vendar to uporablja laktat dehidrogenaza za proizvodnjo laktata in NAD+, ki obnovi NAD+ ki je bila uporabljena med reakcijo, ki jo katalizira gliceraldehid 3-fosfat dehidrogenaza.
Ker je med anaerobiozo glavni vir proizvodnje energije v obliki ATP glikoliza, ima laktat dehidrogenaza temeljno vlogo pri ponovni oksidaciji NADH, ki je nastala v prejšnjih korakih glikolitične poti, ki je bistvenega pomena za delovanje drugih povezanih encimov.
Vam lahko služi: tubulinLaktat dehidrogenaza je vključena tudi v glikogenezo, ki poteka v tkivih, ki pretvorijo laktat v glikogen, in v nekaterih aerobnih tkivih, kot je srce, je laktat gorivo, ki se ponovno sproži za proizvodnjo energije in zmanjšanje moči v obliki ATP in NAD+, oziroma.
Značilnosti in struktura
V naravi obstajajo več molekularne oblike laktat dehidrogenaze. Samo pri živalih je bilo ugotovljeno, da obstaja pet aktivnosti laktat dehidrogenaza, vse tetramerične in v bistvu sestavljene iz dveh vrst polipeptidnih verig, znanih kot podeja H in M (biti lahko homo- ali heterotramérica).
Oblika H je običajno v srčni tkanini, medtem ko je bila oblika M odkrita v skeletnih mišicah. Obe verigi se med seboj razlikujeta glede na številčnost, sestavo aminokislin, kinetične lastnosti in strukturne lastnosti.
Oblike H in M so translacijski produkt različnih genov, ki se nahajajo v različnih kromosomih, ki so tudi pod nadzorom ali regulacijo različnih genov. Oblika H prevladuje v tkivih z aerobnim metabolizmom in v obliki M v anaerobnih tkivih.
Druga vrsta nomenklature uporablja črke A, B in C za različne vrste encimov pri sesalcih in pticah. Tako je znana laktatna mišična dehidrogenaza4, srčni kot b4 in tretjina se imenuje C4, ki je značilno za testise.
Izražanje teh izoencimov je urejeno tako v obliki razvoja odvisnosti in odvisnosti od tkiva.
Encim je bil izoliran iz različnih živali+ Sestavljen je iz β-poskočnega lista, sestavljenega iz šestih verig in 4 alfa propelerjev.
Odločnost
S spektrofotometrijo
Laktatna aktivnost dehidrogenaza živalskega izvora je določena spektrofotometrična In vitro Z meritvami spremembe obarvanja zahvaljujoč postopku oksidiracije, ki poteka med reakcijo pretvorbe laktata piruvata.
Meritve so izvedene pri 340nm s spektrofotometrom in določimo hitrost zmanjšanja optične gostote zaradi oksidacije ali "izginotja" NADH, ki se pretvori v NAD+.
To pomeni, da je odločna reakcija naslednja:
Pyruvate + Nadh + H+ → laktat + NAD+
Encimsko merjenje je treba izvesti v optimalnih pH pogojih in koncentraciji substratov za encim, tako da je tveganje za podcenjevanje količine, ki je prisotna v vzorcih, zaradi primanjkljaja substrata ali ekstremnih pogojev kislosti ali bazičnosti ne deluje.
Z imunohistokemijo
Druga metoda, morda nekoliko modernejša, za določitev prisotnosti laktat dehidrogenaze, je povezana z uporabo imunoloških orodij, torej z uporabo protiteles.
Vam lahko služi: homologija (biologija)Te metode izkoristijo afiniteto med zvezo antigena s protitelesom, ustvarjenim posebej proti njemu in so zelo koristne za hitro določanje prisotnosti ali odsotnosti encimov, kot je LDH v določeni tkanini.
Uporabljena protitelesa morajo biti specifična za odkrivanje katerega koli izoencimov ali za katero koli beljakovino z laktatno aktivnostjo dehidrogenazo.
Zakaj določiti laktat dehidrogenaze?
Določitev tega encima se izvaja z različnimi nameni, predvsem pa za klinično diagnozo nekaterih stanj, vključno z miokardnim infarktom in rakom.
Na celični ravni je bilo sproščanje laktata dehidrogenaze eden od parametrov za določitev pojava nekrotičnih ali apoptotičnih procesov, saj plazemska membrana postane prepustna.
Izdelke reakcije, ki jo lahko kataliz, lahko določimo tudi v tkanini, da se ugotovi, ali anaerobna metabolizem prevladuje iz nekega posebnega razloga.
Reakcija
Kot je sprva komentiral, je encimska laktat dehidrogenaza, katere sistematično ime je (S) -Laktato: NAD+ dehidrogenaza, pretvorba laktata kataliza v piruvat+ odvisen ali obratno, ki se pojavi zaradi prenosa hidridnega iona (H-) Od piruvata do laktata ali od NADH do oksidiranega piruvata.
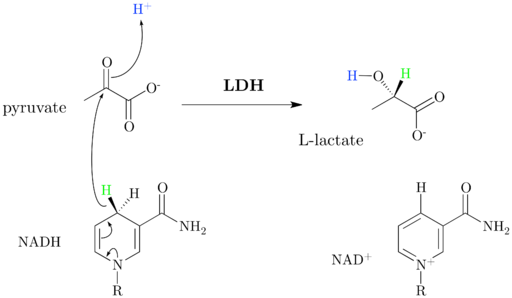 Shema in reakcijski mehanizem laktata dehidrogenaze (vir: jazzlw [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons)
Shema in reakcijski mehanizem laktata dehidrogenaze (vir: jazzlw [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons) NAD+ Ima enoto ADP in drugo nukleotsko skupino, ki izhaja iz nikotinske kisline, imenovana tudi niacin ali vitamin B3, In ta koencim sodeluje pri več reakcijah velikega biološkega pomena.
Pomembno je poudariti, da je ravnovesje v tej reakciji nameščeno na stran, ki ustreza laktatu, in dokazano je, da je encim sposoben oksidirati tudi druge kisline (S) -2 -hidroinokarboksila in uporaba, čeprav manj učinkovita, NADP+ kot substrat.
Glede na telesno območje, ki se upošteva, in hkrati njegove presnovne značilnosti glede na prisotnost ali odsotnost kisika tkiva proizvajajo različne količine laktata, produkt reakcije, ki jo katalizira LDH.
Če na primer rdeča krvna celica (eritrocit), ki nima mitohondrijev, ki lahko presnovi piruvat, ki se proizvaja med glikolizo, do CO2 In voda, potem bi lahko rekli, da so to glavne celice, ki proizvajajo laktat v človeškem telesu, saj se ves piruvat pretvori v laktat z delovanjem laktata dehidrogenaze.
Po drugi strani pa so, če upoštevajo jetrne celice in celice skeletnih mišic, odgovorne za proizvodnjo najmanjše količine laktata.
Vam lahko služi: sabouraud agar: kaj je, fundacija, priprava, uporabaNormalne vrednosti
Koncentracija laktatne dehidrogenaze v krvnem serumu je produkt izražanja več izoencimov v jetrih, srcu, skeletnih mišicah, eritrocitih in tumorjih.
V krvnem serumu so normalni razponi aktivnosti laktata dehidrogenaze med 260 in 850 U/ml (enote na mililiter) s povprečno vrednostjo 470 ± 130 U/ml. Medtem imajo krvni hemoralizirani aktivnost LDH, ki se giblje med 16.000 in 67.000 U/ml, ki je enakovredna povprečju 34.000 ± 12.000 u/ml.
Kaj pomeni imeti visok LDH?
Kvantifikacija koncentracije laktat dehidrogenaze v krvnem serumu ima pomembno vrednost pri diagnozi nekaterih srca, jeter, krvnih bolezni in celo raka.
Visoke številke aktivnosti LDH so bile ugotovljene pri bolnikih z miokardnimi infarkcijami (tako eksperimentalnimi kot kliničnimi), pa tudi pri rakavih bolnikih, zlasti pri ženskah z rakom endometrija, jajčnikov, dojk in maternici.
Odvisno od posebnega izoencima, ki je v "presežku" ali v visoki koncentraciji, kvantifikacijo izoencimov laktata dehidrogenaze uporabljajo mnogi zdravniki za določanje poškodb tkiv (resna ali kronična).
Reference
- Bergmeyer, h., Bent, e., & Hess, b. (1961). Laktična dehidrogenaza. Metode encimske analize. Seelag Chemie, Gmbh.
- Chung, f., Tsujubo, h., Bhattacharyya, u., Sharief, f., & Li, s. (1985). Genomska organizacija gena za človeško laktat dehidrogenazo-A. Journal Biochemical, 231, 537-541.
- Becker, d. (2003). Laktična acidoza. Intenzivna nega med, 29, 699-702.
- Celo, j., & Kaplan, n. (1973). Laktatni dehidrogeni: struktura in funkcija. V Napredek v encimologiji in sorodnih področjih molekularne biologije (str. 61-133).
- Lisica, s. Yo. (2006). Človeška fiziologija (9. izd.). New York, ZDA: McGraw-Hill Press.
- Huijgen, h., Sanders, g. T. B., Koster, r. W., Vreeken, J., & Bossuyt, str. M. M. (1997). Klinična vrednost laktat dehidrogenaze v serumu: kvantitativni pregled. Eur J Clin Chem Clin Biochem, 35(8), 569–579.
- Nomenklaturni odbor Mednarodne zveze za biokemijo in molekularno biologijo (NC-IBMB). (2019). Pridobljeno z www.Qmul.AC.UK/SBCS/IUBMB/ENZIM/INDEX.Html
- Rawn, j. D. (1998). Biokemija. Burlington, Massachusetts: Založniki Neil Patterson.
- USATEGUI-GOMEZ, m., Wicks, r. W., & Warshaw, m. (1979). Imunokemična določitev srčnega izoencima laktat dehidrogenaze (LDH1) v človeškem serumu. Clin Chem, 25(5), 729–734.
- Wróblewski, f., & Ladue, J. S. (1955). Aktivnost laktične degidrogenaze v krvi. Eksperimentalna biologija in medicina, 90, 210-215.
- « Páramo značilnosti, vrste, flora, favna, primeri
- Apolipoprotein in značilnosti, funkcije, bolezni »

