Isopentano struktura, lastnosti, uporabe, pridobivanje
- 2673
- 800
- Don Nitzsche
On Isopentano To je organska spojina, katere kondenzirana formula je (ch3)2Chch2Pogl3. Je alkan, zlasti razvejani izomer pentana, za katerega je značilno, da je zelo nestanovitna tekočina in uporablja kot peneče sredstvo. Trenutno je njegovo najbolj priporočljivo ime IUPAC 2-metilbutana.
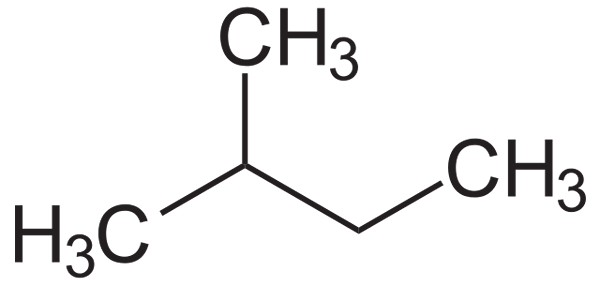
Na spodnji sliki je mogoče videti njegovo strukturno formulo. Upoštevajte, da je skupina ch3 Učinkovito je povezan z ogljikom 2 butilne verige. Iz Isopentano dobimo izopentilni ali izopentilni radikal, saj je eden najbolj zajetnih alkiličnih substituentov, ki so lahko.
 Strukturna formula Isopentana. Vir: Neurotoger / javna domena
Strukturna formula Isopentana. Vir: Neurotoger / javna domena Isopentano je apolarna, hidrofobna in vnetljiva spojina. Njegov vonj je podoben vonju bencina in je del njegove sestave, saj povečuje njegovo oktansko ali oktansko število. Dobimo iz izomerizacijske reakcije n-Pentano, čeprav seveda dosežemo v nekaj količinah v rezervacijah zemeljskega plina.
Če pustite ob strani svoj zelo vnetljiv značaj, Isopentano velja za ne -toksično snov. Oseba ga lahko zaužije in zavoha zmerno, preden se predstavljajo nezaželeni simptomi, kot sta želja po bruhanju in omotičnosti. Isopentano najdete v kremah in balzamih za lase.
[TOC]
Isopentano struktura
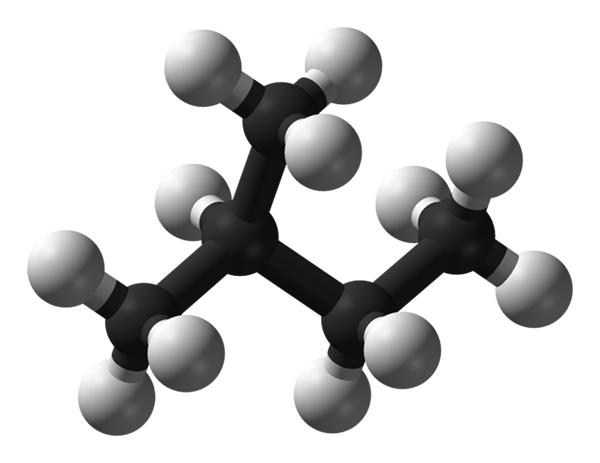 Molekularna struktura Isopentano. Vir: Benjah-BMM27 prek Wikipedije.
Molekularna struktura Isopentano. Vir: Benjah-BMM27 prek Wikipedije. Na vrhunski sliki imamo molekularno strukturo Isopentana, ki jo predstavlja model sfer in palic. Črne kroglice ustrezajo ogljikovim atomom, medtem ko bele kroglice do vodikovega atoma. Od njegovega gaziranega okostja lahko rečemo, da je robusten, razvejan in zajeten.
Vam lahko služi: reakcija premikaKonce molekule Isopentano razumejo skupine CH3, ki so neučinkoviti, ko gre za krepitev medmolekularnih interakcij. Molekule Isopentano so odvisne od disperzivnih sil Londona in njihovih mas, da lahko ostanejo kohezivne, in tako definirajo tekočino v normalnih temperaturnih in tlačnih pogojih.
Vendar njena geometrija in skupine3 Odgovorni so za to, da je tekočina Isopentano zelo hlapna in vre pri temperaturi 28.2 ° C. Na primer linearni izomer n-Pentano zavre okoli 36 ° C, kar je odraz njegovih najboljših intermolekulskih interakcij.
Kljub svoji navidezni robustnosti lahko molekula Isopentano sprejme več vesoljskih konfiguracij, kar je ključni dejavnik pri vzpostavljanju njegovega stekla pri temperaturi -160 ° C.
Lastnosti
Fizični videz
Tekoči ali brezbarven plin, z vodnim videzom, in to daje tudi vonj, podoben vonju po bencinu. Je zelo nestanovitna snov.
Tališče
Isopentano kristalizira temperaturni interval med -161 in -159 ° C.
Vrelišče
Isopentano zavre v temperaturnem intervalu med 27.8 in 28.2 ° C. Zato je komaj izpostavljen zunaj vaše posode bo začel vreti in odvajal velike količine pare.
Parni tlak
76.9 kPa pri 20 ° C (približno 0.76 ATM)
Gostota
0.6201 g/ml pri 20 ° C. Isopentano hlapi so 2.48 gostejše kot zrak.
Topnost
Isopentano za apolarno snov je netopen in nepopustljiv z vodo in nekaj alkoholov. Topna in mešljiva je v parafinskih topilih, etrih, ogljikovem tetrakloridu in tudi v aromatičnih tekočinah, kot je toluen.
Vam lahko služi: kvartarne spojine: značilnosti, usposabljanje, primeriLomni količnik
1.354
Površinska napetost
15 Dyn/cm pri 20 ° C
Goo
0.214 CP pri 20 ° C
Plamenišče
-51 ° C. Ta temperatura naredi izopentano.
Temperatura samostojnosti
420 ° C
Prijave
 Kreme naklonjenosti vsebujejo majhne izopentanske količine, ki delujejo kot pogonsko gorivo in dajejo teksturo izdelka. Vir: Pixabay.
Kreme naklonjenosti vsebujejo majhne izopentanske količine, ki delujejo kot pogonsko gorivo in dajejo teksturo izdelka. Vir: Pixabay. Isopentano je organsko topilo, ki služi kot reakcijsko sredstvo za določeno organsko sintezo in predstavlja tudi surovino za proizvodnjo drugih spojin.
V bencin se doda za povečanje svojega oktana in več kozmetičnih izdelkov, da izboljša svojo teksturo, kot so kreme za britje, enkrat hitro izhlapi in pušča za seboj mehurčno maso.
Podobno se polistiren navlaži v Isopentanu, tako da se pri izhlapevanju plastika razširi, da ustvari nekakšno peno, s katero plovila, modeli, plošče, pladnji itd.
Po drugi strani se Isopentano uporablja v kriogeniji, skupaj s suhim ledom in tekočim dušikom, da zamrzne biološka tkiva in vzorce.
Pridobivanje
Isopentano je mogoče dobiti iz rezervoarjev zemeljskega plina, čeprav le 1% njegove vsebine.
Druga pot, ki se najbolj uporablja na industrijski ravni, temelji na n-Destilatni pentanski procesi rafiniranja nafte. Potem je n-Pentano se podvrže posebni reakciji izomerizacija.
Namen izomerizacije n-Pentano naj bi pridobil svoje najbolj razvejane izomere. Tako med izdelki ne imamo samo Isopentano, ampak tudi Neopentano. Ta reakcija je mogoča z zelo specifičnimi kovinskimi katalizatorji, ki nadzorujejo, kakšno temperaturo in kateri pritiski so potrebni.
Lahko vam služi: lastnosti kovalentnih spojin (s primeri)Tveganja
Isopentano velja za netoksično snov. Deloma je to posledica njegove nizke reaktivnosti, saj njegovih povezav C-C ali C-H ni enostavno razbiti, zato se v nobenem presnovnem postopku ne motijo kot take. Pravzaprav lahko človek pred zadušitvijo vdihne velike količine svojih hlapov, ne da bi očitno utrpel škodo.
Njegov vnos povzroča slabost in bruhanje, njegov stik s kožo pa se konča. Po drugi strani medicinske študije niso mogle določiti, ali je Isopentano rakotvorna snov. Vendar pa velja za nevarno onesnaževalo za morske ekosisteme in njihovo favno.
Največja nevarnost okoli Isopentana ni toliko njegova reaktivnost, ampak v vnetljivosti: gori s kisikom zraka. In ker je njegova tekočina zelo hlapna, bo najmanjši pobeg ločil veliko svojih hlapov proti okolju, kar bo vžgalo najmanj bližine plamena ali katerega koli drugega vira toplote.
Zato morajo biti izdelki, ki vsebujejo Isopentano, hraniti v varnem in svežem okolju.
Reference
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10th Izdaja.). Wiley Plus.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Morrison in Boyd. (1987). Organska kemija. (Peta izdaja). Addison-Wesley Iberoamericana.
- Wikipedija. (2020). Izopentan. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2020). Izopentan. Baza podatkov Pubchem. Cid = 6556. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Elsevier b.V. (2020). Izopentan. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- Jennifer b. Galvin & Fred Marashi. (2010). 2-metilbutan (izopentan). Časopis za toksikologijo in okoljsko zdravje, del trenutnih vprašanj. Zvezek 58, 1999 -Issue 1-2. doi.org/10.1080/009841099157403
- « Značilnosti lipidov, struktura, funkcije, primeri, primeri, primeri
- Značilnosti profesionalne etike, pomen, koda, primeri »

