Imunoglobulini
- 4874
- 839
- Lee Farrell
 Ilustracija imunoglobulinov
Ilustracija imunoglobulinov Kaj so imunoglobulini?
The Imunoglobulini So molekule, ki proizvajajo B limfocite in plazemske celice, ki sodelujejo z obrambo organizma. Sestavljeni so iz biomolekule glikoproteina, ki pripada imunskemu sistemu. So eden najpogostejših beljakovin krvnega seruma, po albuminu.
Protitelo je drugo ime, ki ga imunoglobulini prejemajo, in veljajo za globuline zaradi njihovega vedenja v elektroforezi krvnega seruma, ki jih vsebuje. Molekula imunoglobulina je lahko preprosta ali zapletena, odvisno od tega, ali je vaša predstavitev kot monomer ali je polimerizirana.
Skupna struktura imunoglobulinov je podobna črki "y". Obstaja pet vrst imunoglobulinov, ki imajo morfološke, funkcionalne in lokacijske razlike v telesu. Strukturne razlike protiteles niso v obliki, ampak glede na njihovo sestavo; Vsak tip ima določen cilj.
Imunski odziv, ki ga spodbujajo imunoglobulini, je zelo specifičen in je zelo zapleten mehanizem. Spodbuda za njegovo izločanje s celicami se aktivira v prisotnosti čudnih povzročiteljev telesu, kot je bakterija. Funkcija imunoglobulina bo, da se pridruži čudnemu elementu in ga odpravi.
Imunoglobulini ali protitelesa so lahko prisotni tako v krvi kot na membranski površini organov. Te biomolekule predstavljajo pomembne elemente v sistemu obrambe človeškega telesa.
Struktura imunoglobulinov

Struktura protiteles vsebuje aminokisline in ogljikove hidrate, oligosaharide. Prevladujoča prisotnost aminokislin, njegova količina in porazdelitev je tisto, kar določa strukturo imunoglobulina.
Tako kot kateri koli beljakovine imajo tudi imunoglobulini primarno, sekundarno, terciarno in kvartarno strukturo, kar določa njihov značilen videz.
Kot odgovor na število aminokislin, ki jih predstavljajo, imajo imunoglobulini dve vrsti verige: težka veriga in lahka veriga. Poleg tega ima v skladu z zaporedjem aminokislin v svoji strukturi vsaka veriga spremenljivo območje in stalno območje.
Težke verige
Težke verige imunoglobulinov ustrezajo polipeptidnim enotam, sestavljene iz 440 aminokislinskih sekvenc.
Vsak imunoglobulin ima 2 težki verigi, vsaka pa ima spremenljivo območje in stalno območje. Konstantno območje ima 330 aminokislin in sekvenciranih 110 aminokislin.
Struktura težke verige je za vsak imunoglobulin drugačna. So skupno 5 vrst težke verige, ki določajo vrste imunoglobulina.
Vrste težkih verig so identificirane z grškimi črkami γ, μ, α, ε, δ za IgG, IgM, IGA, IgE in IgD imunoglobuline.
Konstantno območje težkih verig ε in μ tvorita štiri domene, medtem ko imajo tiste, ki ustrezajo α, γ, Δ trije. Nato bo vsako konstantno območje za vsako vrsto imunoglobulina, vendar skupno imunoglobulinom iste vrste.
Vam lahko služi: sternokleidohioidna mišicaSpremenljivo območje težke verige tvori eno samo domeno imunoglobulina. Ta regija ima zaporedje 110 aminokislin in bo drugačna, odvisno od specifičnosti protiteles z antigenom.
V strukturi težkih verig lahko opazimo angulacijo ali upogib - tečaj -, ki predstavlja prožno območje verige.
Lahke verige
Lahke verige imunoglobulinov so polipeptidi, sestavljeni iz približno 220 aminokislin. V človeku obstajata dve vrsti lahke verige: Kappa (κ) in Lambda (λ), slednja s štirimi podtipi. Konstantne in spremenljive domene imajo zaporedje 110 aminokislin.
Protitelo ima lahko dve lahki verigi κ (κκ) ali par verig λ (λλ), vendar ni mogoče hkrati imeti enega od vsake vrste.
Segmenti FC in Fab
Ker ima vsak imunoglobulin obliko, podobno kot "y", razdeliti na dva segmenta. "Spodnji" segment, podstavek, se imenuje kristalizabilna frakcija ali FC; medtem ko roke "y" tvorijo fab ali frakcijo, ki združuje antigen. Vsak od teh strukturnih odsekov imunoglobulina opravlja drugačno funkcijo.
Segment FC
FC segment ima dve ali tri stalne domene težkih verig imunoglobulina.
FC se lahko pridruži beljakovinam ali določenemu sprejemniku v bazofilih, eozinofilih ali ječmenskih celicah, tako da povzroči specifični imunski odziv, ki bo odpravil antigen. FC ustreza karboksilnemu koncu imunoglobulina.
Fab segment
Frakcijski ali fab segment protitelesa vsebuje spremenljive domene na njegovih koncih, poleg konstantnih domen težkih in lahkih verig.
Konstantna domena težke verige se nadaljuje z domenami segmenta FC, ki tvorijo tečaj. Ustreza amino-terminalnemu koncu imunoglobulina.
Pomembnost segmenta Fab je, da omogoča združitev z antigeni, čudnimi in potencialno škodljivimi snovmi.
Spremenljive domene vsakega imunoglobulina zagotavljajo njihovo specifičnost z določenim antigenom; Ta funkcija celo omogoča njegovo uporabo pri diagnozi vnetnih in nalezljivih bolezni.
Vrste imunoglobulinov
 Avtor Alejandro Porto [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)], prek Wikimedia Commons
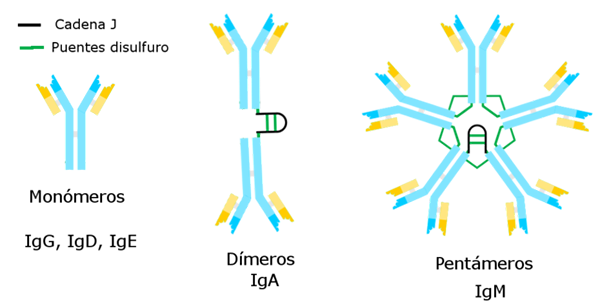
Avtor Alejandro Porto [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)], prek Wikimedia Commons Do zdaj znani imunoglobulini imajo specifično težko verigo, ki je konstantna za vsako od njih, in razliko od drugih.
Obstaja pet sort težkih verig, ki določajo pet vrst imunoglobulinov, katerih funkcije so različne.
Imunoglobulin G (IgG)
Imunoglobulin g je najštevilčnejša raznolikost. Ima težko verigo gama in je predstavljena v nemolekularni ali monomerni obliki.
IgG je najpogostejši tako v krvnem serumu kot v tkivnem prostoru. Minimalne spremembe aminokislinskega zaporedja njene težke verige določajo njihovo delitev na podtipe: 1, 2, 3 in 4.
Vam lahko služi: sarcomroImunoglobulin g ima zaporedje 330 aminokislin v segmentu FC in molekulsko maso 150.000, od tega 105.000 ustreza svoji težki verigi.
Imunoglobulin M (IGM)
Imunoglobulin M je pentaža, katere težka veriga je μ. Njegova molekulska teža je visoka, približno 900.000.
Aminokislinsko zaporedje njene težke verige je 440 v frakciji FC. Pretežno je v krvnem serumu, kar predstavlja 10 do 12 % imunoglobulinov. IGM ima en sam podtip.
Imunoglobulin A (IGA)
Težka veriga α ji ustreza in predstavlja 15 % celotnih imunoglobulinov. IgA najdemo tako v krvi kot v izločkih, tudi v materinem mleku, ki se predstavlja v obliki monomera ali dimera. Molekulska teža tega imunoglobulina je 320.000 in ima dva podtipa: IGA1 in IGA2.
Imunoglobulin E (IgE)
Imunoglobulin E je sestavljen iz težke verige tipa ε in je v serumu zelo malo, približno 0,002 %.
IGE ima molekulsko maso 200.000 in je prisoten kot monomer predvsem v serumu, nosni sluzi in slini. Običajno je tudi to imunoglobulin znotraj bazofilcev in mastocitov.
Imunoglobulin D (IGD)
Sorta težke verige δ ustreza imunoglobulinu D, ki predstavlja 0,2 % celotnih imunoglobulinov. IGD ima molekulsko maso 180.000 in je strukturiran v obliki monomera.
Povezana je z B limfociti, pritrjenimi na površino teh. Vendar funkcija IgD ni jasna.
Sprememba vrste
Imunoglobulini lahko doživijo strukturno spremembo vrste zaradi potrebe po obrambi pred antigenom.
Ta sprememba je posledica funkcije B limfocitov proizvodnih protiteles s prilagodljivo imunostjo lastnosti. Strukturna sprememba je v konstantnem območju težke verige, ne da bi spremenila spremenljivo območje.
Sprememba razreda ali razreda lahko povzroči, da se IgM prenaša na IgG ali IgE, kar se pojavi kot inducirani odziv gama interferona ali IL-4 in IL-5 interleucinov.
Funkcije imunoglobulinov
Vloga, ki jo igrajo imunoglobulini v imunskem sistemu, je ključnega pomena za obrambo organizma.
Imunoglobulini so del humoralnega imunskega sistema; to pomeni, da so snovi, ki jih celice izločajo za zaščito pred patogeni ali škodljivimi sredstvi.
Zagotavljajo učinkovito obrambno sredstvo, učinkovito, specifično in sistematizirano, saj so kot del imunskega sistema zelo pomembne. Imajo splošne in posebne funkcije znotraj imunosti:
Splošne funkcije
Protitelesa ali imunoglobulini izpolnjujejo neodvisne funkcije in aktivirajo efektorske in sekretorne odzive, ki jih posredujejo celice.
Antigen-antigen-Aertuerpo Union
Imunoglobulini imajo funkcijo združevanja antigenih zdravil posebej in selektivno.
Nastajanje kompleksa antigena-protitelesa je glavna funkcija imunoglobulina, zato je imunski odziv, ki lahko ustavi delovanje antigena. Vsako protitelo se lahko pridruži dve ali več antigenov hkrati.
Vam lahko služi: alveolarna kostUčinkovite funkcije
Večino časa kompleks antigen-protiteles služi kot začetek aktiviranja specifičnih celičnih odzivov ali začetka zaporedja dogodkov, ki določajo izločanje antigena. Dva najpogostejša odziva efektorja sta celica in aktiviranje dopolnitve.
Celična zveza je odvisna od prisotnosti specifičnih receptorjev za segment imunoglobulina FC, ko se pridruži antigenu.
Celice, kot so mastociti, eozinofili, limfocitni bazofili in fagociti, imajo te receptorje in zagotavljajo mehanizme za odstranjevanje antigena.
Aktivacija komplementarnega slapa je kompleksen mehanizem, ki vključuje začetek zaporedja, zato je končni rezultat izločanje strupenih snovi, ki odpravljajo antigene.
Posebne funkcije
Prvič, vsaka vrsta imunoglobulina razvije specifično obrambno funkcijo:
Imunoglobulin g
- Imunoglobulin G zagotavlja največ obrambe proti antigenim zdravilom, vključno z bakterijami in virusi.
- IgG aktivni mehanizmi, kot sta dopolnilo in fagocitoza.
- Specifična ustava IgG za antigen je trajna.
- Edino protitelo, ki ga lahko mati prenese na otroke med nosečnostjo, je IgG.
Imunoglobulin m
- IGM je protitelo s hitrim odzivom pred škodljivimi in nalezljivimi povzročitelji, saj zagotavlja takojšnje ukrepanje, dokler ga ne nadomesti IgG.
- To protitelo aktivira celične odzive, vključene v membrano humoralnih limfocitov in odzivov, kot je dopolnilo.
- To je prvi imunoglobulin, ki sintetizira človeka.
Imunoglobulin a
- Deluje kot obrambna ovira pred patogeni, ko se nahaja na površinah sluznice.
- Prisoten je v dihalni sluznici, prebavnem sistemu, sečnici in tudi v izločkih, kot so slina, nosna sluz in solze.
- Čeprav je njegova aktivacija komplementa nizka, je lahko povezana z gladkostjo, da odpravite bakterije.
- Prisotnost imunoglobulina D v materinem mleku in v kalosterju omogoča novorojenčku, da ga pridobi med dojenjem.
Imunoglobulin e
- Imunoglobulin in zagotavlja močan obrambni mehanizem proti proizvajalcem alergij.
- IgE interakcija in alergen bo vnetljive snovi odgovorno za simptome alergij, kot so kihanje, kašelj, panje, povečanje solz in nosna sluz.
- IgE lahko povežete tudi na površino zajedavcev skozi njen segment FC, kar povzroči reakcijo, ki povzroči smrt le -teh.
Imunoglobulin d
- Monomerna struktura IgD je povezana z B limfociti, ki niso sodelovali z antigeni, zato opravljajo funkcijo receptorja.
- Funkcija IGD je nejasna.

