Struktura natrijevega hidroksida (NaOH), lastnosti, uporabe, sinteza

- 3102
- 801
- Miguel Gutmann DVM
On natrijev hidroksid Gre. 5 %raztopina v vodi ima pH blizu 14.
Je zelo higroskopska bela trdna snov, ki lahko absorbira tudi ogljikov dioksid zraka, da tvori natrijev karbonat. Trgovinsko na voljo v plastičnih steklenicah, kot so tablete, ki jih ni mogoče izpostaviti preveč časa v zraku, niti z njimi ne bi smeli manipulirati z lopaticami.
 Tablete natrijevega hidroksida na kozarcu. Vir: Noben strojno berljiv avtor. Walkerma je domnevala (na podlagi zahtevkov za avtorske pravice). [Javna domena]
Tablete natrijevega hidroksida na kozarcu. Vir: Noben strojno berljiv avtor. Walkerma je domnevala (na podlagi zahtevkov za avtorske pravice). [Javna domena] Natrijev hidroksid lahko sintetiziramo pri reakciji kalcijevega hidroksida z natrijevim karbonatom. Trenutno ga v osnovi sintetizira elektroliza slanice in je sekundarni produkt proizvodnje plinskega klora.
Daj. Uporablja se tudi pri čiščenju doma, čiščenju vode, predelavi aluminija, proizvodnji zdravil itd.; In predvsem gre za sekundarni vzorec odličnosti.
Natrijev hidroksid je zelo jedran, saj lahko povzroči draženje in opekline kože. Z vdihavanjem prahu lahko povzroči pljučni edem. Medtem lahko njegovo zaužitje povzroči tako hude poškodbe prebavnega trakta, ki lahko privedejo do smrti.
[TOC]
Struktura
Brezvodna
 Naoh ioni. Vir: Gabriel Bolívar.
Naoh ioni. Vir: Gabriel Bolívar. Vrhunska slika prikazuje ione, ki sestavljajo NaOH. Na kation+ Predstavlja ga vijolična krogla, medtem ko hidroksilni anion (hidroksid ali oksidril) OH- Za rdečo in belo sfero. Oba Na iona+ in oh- Med seboj sodelujejo z elektrostatično privlačnostjo svojih nasprotnih obremenitev.
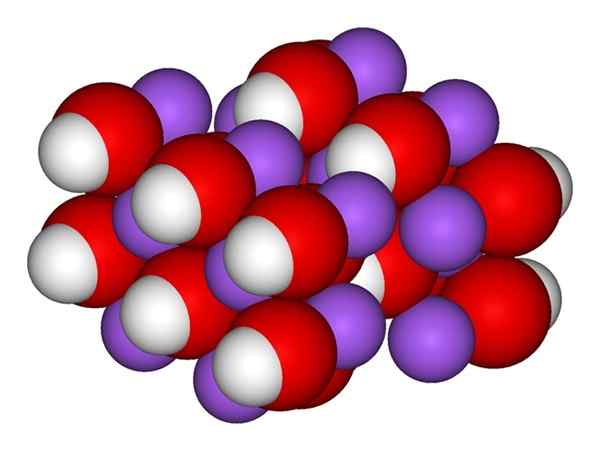 Struktura natrijevega hidroksida
Struktura natrijevega hidroksida Takšne interakcije niso usmerjene, zato so atrakcije ionskega Na+Oh- lahko vplivajo na druge na določeni razdalji. Rezultat tega je, da ioni NA+ Med seboj se odbijajo, na enak način kot OH-, Dokler ne določite minimalnega energijskega kristala, kjer vzpostavijo urejeno in periodično strukturo (kristalno).
Zato se pojavlja ortorrombični kristali NaOH anhidro (brez vode):
 Predstavitev kristalne strukture brezvodnega natrijevega hidroksida. Vir: Quibik prek Wikipedije.
Predstavitev kristalne strukture brezvodnega natrijevega hidroksida. Vir: Quibik prek Wikipedije. Ioni ostanejo dovolj kohezivni, da se brezvodni kristal NaOH na podlagi 323 ° C (pod pogojem, da v okolju ni vlage).
Hidrati
Oba na+ Kot oh- So ioni, ki molekule vode solvetan (hidrirajo) zlahka. To daje prednost svoji hidraciji nad retikularno energijo svojih kristalov, zato NaOH sprosti veliko energije, ko pride v stik z vodo.
Lahko vam služi: Fehling Reakcija: pripravki, aktivni povzročitelji, primeri, uporabeVendar lahko brezvodni kristali gostijo molekule vode, ne da bi se raztopili; to pomeni, da lahko natrijev hidroksid tvori številne hidrate, NaOH · NH2Tudi. Molekula vode lahko tvori vodikov most z OH- (Hoh-oh-) ali se usklajuje z NA+ (Na+-Oh2).
Odvisno od molarnega deleža med NaOH in H2Ali pa se lahko pojavijo monohidrati (NaOH · H2O), dihidrati (NaOH · 2H2O), trihemakrati (NaOH · 3.5H2O), tetrahidrati (NaOH · 4H2O), heptahridati (NaOH · 7H2O) in drugi.
Vsak ti hidrati se lahko kristalizirajo iz vodne raztopine NaOH z različnimi odstotki mase in pri različnih temperaturah. Posledično ima NAOH zapleten diagram topnosti vode.
Na splošno so kristali hidratov manj gosti in imajo nižje talilne točke. To je zato, ker molekule vode "ovirajo" interakcije med NA+ in oh-, Dodajanje dipol-dipolnih sil v žrtvovanje ionskih znamenitosti.
Fizikalne in kemijske lastnosti
Imena
IOPAC Prednostno ime: natrijev hidroksid. Druga imena: kavstična soda, Ascarita (manj pogosta)
Molarna masa
39.9971 g/mol
Videz
Trdni ali beli, serozni ali neprozorni kristali.
Tališče
323 ° C
Vrelišče
1.388 ° C
Topnost vode
1.000 g/l pri temperaturi 25 ° C. To dokazuje, koliko se lahko raztopi v vodi.
Njegove vodne raztopine so viskozne, z vrednostjo viskoznosti skoraj osemdesetkrat večjo kot pri vodi in na začetku sproščajo zelo toploto. Če imate stik z njimi, obrnejo spolzko kožo zaradi saponifikacije maščobnih kislin kože.
Basicy (PKB)
- 0,56
ph
Raztopina 5 % P/P v vodi ima pH blizu 14
Indeks loma (ND)
Pri valovni dolžini 580,4 nm: 1.433 do 320 ° C in od 1.421 do 420 ° C.
Stabilnost
Posode, ki ga vsebujejo, morajo biti tesno zaprte, da se prepreči tvorba natrijevega karbonata. To je posledica njegove visoke higroskopnosti, zaradi česar absorbira vlago svojega okolja in svoje co -vsebine2.
Razgradnja
Ko se segreva na razgradnjo, oddaja dim iz natrijevega oksida.
Samosvojna točka
Ni vnetljivo
Goo
4.0 Cpoise pri 350 ° C
Toplota za uparjanje
175 kJ/mol a 1.388 ° C
Površinska napetost
74,35 DINAS/cm v 2,72 % raztopini P/P v vodi pri 18 ° C.
Reaktivnost
S kislinami
Reagira z organskimi in anorganskimi mineralnimi kislinami, kar povzroča vodo in ustrezno sol. V primeru žveplove kisline je reakcija eksotermična.
Vam lahko služi: aluminijev sulfid (AL2S3): struktura, lastnosti, uporabe2 NaOH+H2SW4 => Na2SW4 + 2 h2Tudi
S kislimi oksidi
Reagira na primer z žveplom dioksidom, ki daje sol sulfita in vode:
2 NaOH +SO2 => Na2SW3 + H2Tudi
S kovinami
Njegove vodne raztopine reagirajo z nekaterimi kovinami, da povzročijo zapletene natrijeve soli. Na primer, njegova reakcija s cinkom povzroči natrijev cincato:
Zn + 2 NaOH + 2 h2O => na2[Zn (OH)4] + H2
Sinteza
Natrijev hidroksid se v glavnem sintetizira z dvema metodama: uporaba natrijevega karbonata, prvotno uporabljene in natrijevega kloridnega elektrolize, ki je trenutno večja industrijska uporaba.
Natrijev karbonat reakcija in kalcijev hidroksid
Natrijev karbonat reagira s kalcijevim hidroksidom v postopku, znanem kot kaustifikacija:
CA (OH)2 + Na2Co3 => Caco3 + Naoh
Kalcijevi karbonatni oborini, ki puščajo natrijev hidroksid v supernatantu, ki je koncentriran z izhlapevanjem.
Natrijev karbonat prej izvira iz procesa Solvay:
2 NaCl+ caco3 => Na2Co3 + Cacl2
Elektroliza natrijevega klorida
Natrijev kloridni elektroliza, ki je prisotna v slanici, proizvaja vodikov plin, kloridni plin in natrijev hidroksid v vodni raztopini:
2 NaCl+2 h2O => h2 + Cl2 + 2 Naoh
Elektrolitična komora je sestavljena iz predela, kjer je anoda (+), kovine iz titana in mesta, kjer je postavljena slanica. Ta predal je ločen od katodnega prostora (-) z uporabo porozne membrane.
Naslednja reakcija se pojavi pri anodi:
2 Cl- => Cl2 + 2 e- (oksidacija)
Medtem se ta reakcija pojavi v katodi:
2 h2O +2 e- => H2 + Oh- (Zmanjšanje)
Natrij (na+) razpršite od anodnega prostora do katode, skozi membrano, ki jih ločuje, in tvori natrijev hidroksid.
Prijave
Čistilni izdelki
Natrijev hidroksid se uporablja za proizvodnjo mil in detergentov, ki se uporabljajo doma in v komercialni dejavnosti. Kombinacija natrijevega in klora hidroksida proizvaja belilo klora, ki se uporablja pri pranju belih oblačil.
Prav tako odpravlja kopičenje maščobe v odtokih in s pretvorbo v mila povzroči izločanje skozi postopek saponifikacije. To omogoča odpravo ovire gospodinjskih cevi in drugih zgradb.
Farmacevtski in zdravilni izdelki
Natrijev hidroksid se uporablja pri izdelavi skupnih analgetikov, kot je aspirin. Tudi zdravil z antikoagulantnim delovanjem, ki blokirajo nastanek krvnih strdkov in zdravil za zmanjšanje hiperholesterolemije.
Energetski procesi
Natrijev hidroksid se uporablja pri proizvodnji gorivnih celic, ki delujejo kot baterije za proizvodnjo električne energije za različne aplikacije, vključno s prevozom. Epoksi smole, proizvedene z intervencijo natrijevega hidroksida, se uporablja v vetrnih turbinah.
Lahko vam služi: galvanska korozija: mehanizmi, primeri, zaščitaČiščenje vode
Natrijev hidroksid se uporablja za nevtralizacijo kislosti vode in prispevanje k izločitvi težkih kovin. Uporablja se tudi za proizvodnjo natrijevega hipoklorita, razkužilo z vodo.
Natrijev hidroksid reagira z aluminijevim sulfatom za tvorbo aluminijevega hidroksida: flokulantno sredstvo, ki se uporablja v čistilnih napravah.
Izdelava papirja
Natrijev hidroksid se uporablja z natrijevim sulfidom pri obdelavi lesa za pridobivanje celuloze na skoraj čist način, ki tvori osnovo papirja. Uporablja se tudi pri recikliranju papirja, saj s pomočjo ločitve črnila nam omogoča, da ga ponovno uporabimo.
Industrijska proizvodnja
Natrijev hidroksid se uporablja pri proizvodnji Rayóna, Spandexa, eksploziva, epoksi smole, stekla in keramike. Uporablja se v tekstilni industriji za barvila in obdelave bombažnih tkanin.
V čistilnih napravah se uporablja za proizvodnjo sladkornega trsa z nizko temperaturo natrijevega hidroksida.
Tveganja
Natrijev hidroksid je zelo korozivna spojina, tako da lahko povzroči stik s kožo, opeklinami, ampulami in celo trajnimi brazgotinami.
V stiku z očmi lahko povzroči resne opekline, otekanje, bolečino, zamegljen vid in v hudih primerih lahko povzroči trajno slepoto.
Zaužitje natrijevega hidroksida lahko povzroči opekline na ustnice, jezik, grlo, požiralnik in želodec. Med običajnimi simptomi se manifestirajo slabost, bruhanje, želodec in driska.
Čeprav je vdihavanje natrijevega hidroksida redek in se lahko pojavi le zaradi prisotnosti sestavljenega prahu v zraku ali zaradi tvorbe rosice, ki ga vsebuje, v pljučih povzroči draženje.
V primeru kronične izpostavljenosti lahko to povzroči pljučno edemo in hudo skrajšanje dihanja, kar predstavlja medicinsko pomoč.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). Natrij hidroksida. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2019). Natrij hidroksida. Baza podatkov Pubchem. Cid = 14798. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Ameriški elementi. (2019). Raztopina natrijevega hidroksida. Pridobljeno od: Americanments.com
- Dejstva o kemični varnosti. (2019). Natrij hidroksida. Okrevano od: ChemicalSafetyFacts.org
- NJ zdravje. (2015). Natrij hidroksida. [PDF]. Okreval od: NJ.Gov
- Kanadski center za zdravje in varnost pri delu. (2019). OSH Odgovori Dejanske liste: natrijev hidroksid. Okrevano od: cohs.AC
- Ausetute. (s.F.). Proizvodnja natrijevega hidroksida in klora z elektrolizo. Okrevano od: ausetute.com.Au
- « Izvor jezika chol, značilnosti, kje se govorijo, besede
- Značilnosti indeksiranih revij, kriteriji, vplivni primeri »

