Struktura kalijevega hidroksida, lastnosti, uporablja

- 2861
- 26
- Raymond Moen
On Kalijev hidroksid Je bela kristalna anorganska trdna snov. Njegova kemična formula je koh. Njeni kristali zlahka absorbirajo zrak iz zraka, zato se reče, da gre za higroskopsko spojino. Je močna podlaga in absorbira ogljikov dioksid (CO2) okolja.
Industrijsko se pojavlja z elektrolizo kalijevega klorida (KCL). Zaradi razlogov za ohranjanje energije in čistost izdelka se pri tej metodi uporabljajo živosrebne celice (HG).
 Kalijevi hidroksidni biseri (koh). Noben strojno berljiv avtor ni zagotovil. Walkerma je domnevala (na podlagi zahtevkov za avtorske pravice). [Javna domena] Vir: Wikipedia Commons
Kalijevi hidroksidni biseri (koh). Noben strojno berljiv avtor ni zagotovil. Walkerma je domnevala (na podlagi zahtevkov za avtorske pravice). [Javna domena] Vir: Wikipedia Commons Toda že vrsto let skrbi za kontaminacijo živega srebra, ki ustvarja ta postopek. Dejansko so izpusti na odpadke, ki vsebujejo živo srebro. Obstajajo tudi drugi procesi, kot sta diafragma in membrana.
Obstajajo tudi neelektrokemijski procesi, kot je razgradnjo kalijevega nitrita (kno2) V prisotnosti železovega oksida (vera2Tudi3).
KOH rešitve, pridobljene v industrijskih procesih, izhlapijo, da dosežejo KOH pri 90-95%. 5-10% preostale vseb.H2Da).
Zaradi kavstičnih lastnosti in močne bazičnosti ima zelo raznolike aplikacije. Služi kot surovina v milih in detergentih, tiskanih ali kozmetičnih črnilih, med drugim. Uporablja se tudi za umivanje industrijskih plinov, pri odkrivanju gliv z mikroskopom in ima uporabo v prehrambeni industriji.
Čeprav gre za zelo stabilno spojino, je razvrščena kot jedska. Manipulira ga previdno, saj lahko povzroči opekline v očeh, koži in sluznici.
[TOC]
Struktura
KOH kristal pri navadnih temperaturah je monokliničen, pri čemer je vsak atom kalija (k) obkrožen z oktaedro, popačeno iz kisikovih atomov (O). Skupine hidroksilne (OH) tvorijo verigo v obliki cikcak, povezane z vodiki, kjer so O-O razdalje 3,35 A.
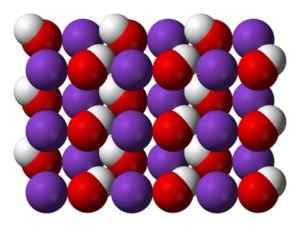 Kristalna struktura KOH pri običajnih temperaturah. Modra: kalij, rdeča: kisik, bela: vodik. Benjah-BMM27 [javna domena]. Vir: Wikipedia Commons
Kristalna struktura KOH pri običajnih temperaturah. Modra: kalij, rdeča: kisik, bela: vodik. Benjah-BMM27 [javna domena]. Vir: Wikipedia Commons Koh ima pri visokih temperaturah kubično kristalno obliko.
Lahko vam služi: križarjenje po lončku: značilnosti, funkcije, uporabite primereNomenklatura
- Kalijev hidroksid.
- Kavstična kalija.
- Kalijev hidrat.
- Kalijev belilo.
Lastnosti
Fizično stanje
Bela kristalna trdna.
Molekularna teža
56,106 g/mol.
Tališče
380 ° C; Poročali so tudi o 406 ° C (razlikuje se glede na vsebnost vode). Tehnična stopnja (90-92% KOH) se stopi približno 250 ° C.
Vrelišče
1327 ° C.
Gostota
2.044 g/cm3
Topnost
Topno v hladni vodi (107 g/100 ml pri 15 ° C) in vroče vode (178 g/100 ml pri 100 ° C). Njegova raztapljanje v vodi je zelo eksotermičen postopek, kar pomeni, da nastaja velika količina toplote.
Topno v alkoholih. Topno v glicerinu. Netopna v etru.
ph
13,5 (v 0,1 molarni vodni raztopini).
Druge lastnosti
Njeni kristali so delikue ali higroskopski, kar pomeni, da absorbira zrak iz zraka. Tudi zlahka absorbira co2 iz zraka.
Njegove kemijske reakcije so značilnosti močne osnove. V vodni raztopini reagira s katero koli šibko kislino, da tvori kalijevo sol kisline. Na primer reagira z ogljikovo kislino (h2Co3) ali z ogljikovim dioksidom (CO2) Tvoriti bikarbonat ali kalijev karbonat.
Reagira z alkoholi, da tvori kalijevi alkoksidi ali z vodikovim sulfidom H2S za tvorbo sulfida ali kalijevega bisulfida.
V vodnih sistemih KOH tvori več hidratov: mono-, di- in tetra-hidrate.
Vodne raztopine Koh so brezbarvne, močno osnovne, milne in kavstične. Je koroziven material, tako trden kot v raztopini.
Ni vnetljivo, toda ko se segreje, dokler njegova razgradnja ne oddaja strupenih in jedkih kadil K2Tudi.
Povzroči hude opekline v očeh, koži in sluznici ter v stiku s kovinami, kot so aluminij, kositer, svinec ali cink, lahko ustvarijo evolucijo vodikovega plina (H2), kar je zelo vnetljivo.
Toplota, ki nastane, ko pride v stik z vlago ali drugimi snovmi, lahko povzroči dovolj toplote, da vklopi gorljive materiale.
Prijave
V proizvodnji drugih kalijevih spojin
Kalijev hidroksid se uporablja kot surovina za kemično in farmacevtsko industrijo. Služi za proizvodnjo kalijevega karbonata (k2Co3), Kalijev permanganat (kmno4), kalijev fosfat (k3Po4), kalijev silikat (k2Sio3) in kalijev cianid (KCN), med drugimi spojinami.
Vam lahko služi: linearne alkane: struktura, lastnosti, nomenklatura, primeriV več aplikacijah
Visoka čistost KOH ima uporabo v proizvodnji pesticidov, sintezi črnila in barvil, kemikalij za gumo ali galvanoplastiko, litografijo itd.
Tehnična stopnja KOH se uporablja kot surovina v industriji detergentov in mil; pri izdelavi kozmetike, stekla in tekstila; za oživitev surove nafte; Kot sušilno sredstvo in pri odstranjevanju slik in lakov med drugimi aplikacijami.
Uporabno je tudi kot kavstično sredstvo v lesni industriji, pri bombažni mercerizaciji, v analitični kemiji za alkalimetrične naslove, organsko in vodenje vode.
V medicinskih aplikacijah
V medicini se uporablja pri mokrem sestavljanju med pripravo kliničnih vzorcev za mikroskopsko vizualizacijo gliv in drugih glivičnih elementov v usnju, laseh, žebljih.
Priprava KOH se uporablja za razjasnitev kliničnega gradiva, tako da se glivične elemente lažje vidijo.
Klinični fragment vzorca dodamo 10% del raztopine KOH na steklenem diapozitivu. Nato pokrijte s objektom pokrova in pustite stati pri sobni temperaturi, da omogočite prebavo gostiteljskih celic. Končno ga opazimo z mikroskopom.
 Mikroskop. Slika Kontantin Kolosov. Vir: Pixabay
Mikroskop. Slika Kontantin Kolosov. Vir: Pixabay Po drugi strani je KOH v obliki aktualne raztopine učinkovit pri zdravljenju bradavic.
V kozmetični industriji
Uporablja se v nekaterih izdelkih za čiščenje nohtov, kremam in mila za britje, saj je njegova jedska lastnost zelo učinkovita pri razpadu ali odstranjevanju mehkih tkiv in odstranjevanja dlak.
 Mila. Obredna slika. Vir: Pixabay
Mila. Obredna slika. Vir: Pixabay V kmetijstvu
Uporablja se v gnojilih in drugih kmetijskih proizvodih, kot so herbicidi in pesticidi.
V industrijskih kemičnih procesih
KOH je uporaben pri čiščenju in čiščenju industrijskih plinov, zlasti kadar je potrebno odstraniti kisline.
Vam lahko služi: Henderson-Haselbalch Enačba: Pojasnilo, primeri, vadbaNa primer, da lahko reagira s CO2, Uporablja se za absorpcijo tega plina. Poleg tega je idealno reagirati s kislinami, zato služi za odstranjevanje sulfhidrične kisline (h2S). In podobno, da odstranimo dušikove okside.
 Industrijski proces. Slika Michaela Gaide. Vir: Pixabay
Industrijski proces. Slika Michaela Gaide. Vir: Pixabay V živilski industriji
Uporablja se za prilagajanje pH, kot stabilizator in kot zgoščevanje v živilski industriji.
Uprava za hrano in zdravila je obravnavala ali FDA (za svojo kratico za angleščino Uprava za hrano in zdravila), Kot neposredna sestavina pri ljudeh, pod pogojem, da se uporablja pod pogoji, povezanimi z dobrimi proizvodnimi praksami.
Pri pridobivanju biodizla
Biodizel je dizelska ali dizelska nadomestna tekočina. Dobimo ga iz rastlinskih olj ali živalskih maščob. KOH je bil uporabljen kot katalizator pri proizvodnji biodizla.
Nedavne študije
Nekaj let se pozornost posveča kontaminaciji morja zaradi plastičnih odpadkov, ki prizadenejo več kot 550 vrst morske favne, tako zaradi zaužitja plastike kot tudi za ujete med odpadki.
Zaradi tega poskušamo najti metode, ki omogočajo predelavo vzorcev prebavnih traktov živali, raztapljanje organskega materiala, vendar brez raztapljanja plastike, ki jih zaužijejo vzorci.
V tem smislu je bilo ugotovljeno, da je uporaba rešitev KOH za ločevanje plastike od organske snovi praktična in učinkovita metoda, ki je lahko zelo koristna v kvantitativnih študijah zaužitja plastike s strani divjih živali divjih živali.
Reference
- Mahmoud a. Ghanoum in Nancy c. Iseham. (2009). Dermatofiti in dermatofitoza. V klinični mikologiji. Druga izdaja. Okrevano od Scientirect.com.
- Kühn, s. et al. (2016). Uporaba raztopine iz kalijevega hidroksida (KOH) kot primeren pristop k izolaciji plastike, ki jo zaužijejo morski organizmi. V biltenu morskega onesnaževanja. Okrevano od Scientirect.com.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Kirk-Othmer (1994). Enciklopedija kemijske tehnologije. Zvezek 19. Četrta izdaja. John Wiley & Sons.
- Ullmannova enciklopedija industrijske kemije. (1990). Peta izdaja. Zvezek A22. VCH Verlagsgellschaft MBH.
- Nacionalna knjižnica medicine. (2019). Kalijev hidroksid. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Krisada Nooiroj, et al. (2009). V primerjalnem študiju Koh/Al2Tudi3 in katalizatorji Koh/Nay za proizvodnjo biodizla s pomočjo trancecerifikacije iz palmovega olja. V obnovljivi energiji. Okrevano od Scientirect.com.
- « Značilnosti organizacijskih vrednot, pomen, primeri
- Ozemlje Alsacia in Lorena, ozadje, svetovne vojne »

