Stroncijev hidroksid (SR (OH) ₂)

- 1046
- 142
- Stuart Armstrong
 Stroncijev hidroksid
Stroncijev hidroksid Kaj je stroncijev hidroksid?
On Stroncijev hidroksid (SR (OH) ₂) je anorganska kemična spojina, ki jo tvori stroncijev ion (SR) in dva hidroksidna iona (OH). To spojino dobimo tako2.
Na splošno se za pripravo stroncijevega hidroksida, natrijevega hidroksida (NaOH) ali kalijevega hidroksida (KOH) uporablja kot močna podlaga. Po drugi strani je stroncijska sol (ali stroncijev ion), ki reagira z močno podlago, nitrat stroncija Sr (ne3)2 In postopek opisuje naslednja kemična reakcija:
2KOH + SR (št3)2 → 2kno3 + Sr (oh)2
V raztopini Stroncijev kation (SR+) Stopi v stik s hidroksidnim anionom (oh-) oblikovanje osnovne ionske stroncijske soli. Ker je stroncij alkalna kovina, stroncijev hidroksid velja za kavstično alkalno spojino.
Pridobivanje stroncijevega hidroksida
Poleg predhodno pojasnjenega postopka lahko rečemo, da ko reakcija izvede, SR (OH)2 oborino v raztopini. Potem je to podvrženo postopku pranja in sušenja, na koncu pa dobimo zelo lep beli prah.
Alternativna metoda za pridobivanje stroncijskega hidroksida je pri segrevanju stroncijskega karbonata (SRCO3) ali stroncijev sulfat (SRSO4), s paro pri temperaturi med 500 ° C in 600 ° C. Kemična reakcija se pojavi, kot je prikazano spodaj:
Srco3 + H2O → SR (OH)2 + Co2
SRS + 2H2O → SR (OH)2 + H2S
Vam lahko služi: žveplova kislinaKemična struktura in fizikalno -kemijske lastnosti
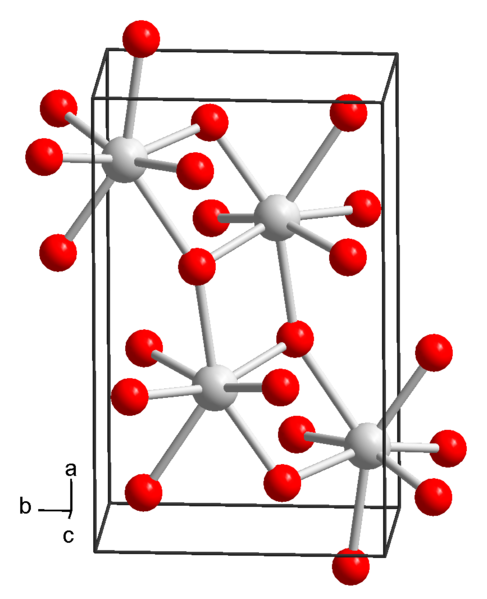 Kemična struktura stroncija hidroksida. Vir: Wikimedia Commons
Kemična struktura stroncija hidroksida. Vir: Wikimedia Commons Trenutno so znane 3 oblike stroncijskega hidroksida: oktahidrat, monohidrat in brezvoljna.
Oktonirani stroncijev hidroksid
Od raztopin v normalnih temperaturnih in tlačnih pogojih (25 ° C in 1 atm) se stroncijev hidroksid obori na oktahidratni način, katere kemijska formula je SR (OH)2∙ 8h2Tudi.
Ta spojina ima molarno maso 265,76 g/mol, gostoto 1,90 g/cm in oborine kot tetragonalni kristali (s prostorsko skupino P4/NCC) kvadratnega prizmatičnega videza in brezbarvnih.
Prav tako ima oktonizirani stroncijev hidroksid možnost absorbiranja atmosferske vlage, saj je zlahka okusna spojina.
Monohidrirani stroncijev hidroksid
Glede na študije optične mikroskopije (izvedene s tehniko difrakcije X -Ray) z dvigom temperature na približno 210 ° C - konstantni atmosferski tlak - SR (OH)2∙ 8h2O je dehidriran in pretvorjen v monohidriran stroncijev hidroksid (SR (OH)2∙ h2Da).
Ta oblika spojine ima molarno maso 139,65 g/mol, njegova temperatura taljenja pa je -73,15 ° C (375k). Zaradi svoje atomske konfiguracije to predstavlja manj topnosti v vodi, kot je opisana v obliki oktahidrata.
Brezvodni stroncijev hidroksid
Z nadaljevanjem povečanja temperature sistema na približno 480 ° C se dehidracija podaljša, dokler brezvodni raztegljivi hidroksid podaljša.
Za razliko od svojih hidriranih oblik ima molarno maso 121,63 g/mol in gostoto 3.625 g/cm3. Njegova vrelišča je dosežena pri 710 ° C (1,310 ° F ali 983 K), medtem ko je tališče pri 535 ° C (995 ° F ali 808 K).
Vam lahko služi: ididio 192Topnost
Stroncijev oktahidratni hidroksid ima topnost vode 0,91 grama na 100 mililitrov (merjeno pri 0 ° C), medtem ko ima njegova brezvodna oblika v podobnih temperaturnih pogojih topnost 0,41 grama na 100 mililitrov.
Podobno se ta snov šteje za netopno v acetonu in popolnoma topno v kislinah in amonijevem kloridu.
Kemična reaktivnost
Stroncijev hidroksid ni vnetljiv, njegova kemična reaktivnost ostaja stabilna pri zmernih temperaturah in pritiskih in lahko absorbira ogljikov dioksid iz atmosferskega zraka, ki ga pretvori v stroncijev karbonat.
Poleg tega je močno dražilna spojina, če stopite v stik s kožo, dihali ali drugimi sluznimi membranami.
Uporablja se stroncijev hidroksid
Zaradi svojih higroskopskih značilnosti in osnovnih lastnosti se za različne aplikacije v industriji uporablja stroncijev hidroksid:
- Moice ekstrakcija in rafiniranje sladkorja iz pese.
- Plastični stabilizator.
- Maščobe in maziva.
Moice Extraction in Rafiniranje sladkorja iz pese
Na začetku 21. stoletja se je v Nemčiji začel raztegniti hidroksid za rafiniranje pese s patentiranega postopka Carl Scheibler leta 1882.
Ta postopek je sestavljen v mešanici stroncijevega hidroksida in sladke kaše pese, kar ima za posledico netopni disaharid. Ta rešitev se loči z dekantacijo in ko se postopek rafiniranja izvede, se sladkor pridobi kot končni izdelek.
Čeprav se ta postopek še vedno uporablja, obstajajo tudi druge metode z veliko več povpraševanja po cenejšem, ki se uporabljajo v veliki večini svetovnih rafinerij sladkorja. Na primer, metoda Barsil, ki uporablja barijev silikat ali Steffenovo metodo, uporablja apno kot ekstraktorsko sredstvo.
Vam lahko služi: anomerni ogljik: kaj je, značilnosti, primeriStroncijske maščobe
Mazijo maščobe, ki vsebujejo stroncijev hidroksid. Te se lahko močno držijo površin s kovinskimi lastnostmi, so odporne na vodo in podpirajo nenadne temperaturne spremembe.
Zaradi dobre fizikalne in kemične stabilnosti se te maščobe uporabljajo kot industrijska maziva.
Plastični stabilizator
Velika večina plastike, ki je izpostavljena podnebnim dejavnikom, kot so sonce, dež in atmosferski kisik.
Zaradi svoje velike odpornosti na vodo v te polimere dodamo stroncijev hidroksid - med fuzijsko fazo - ki deluje kot stabilizator pri izdelavi plastičnih izdelkov, da podaljša njegovo življenjsko dobo.
Druge aplikacije
- V industriji barv se uporablja kot bistveni dodatek za pospešitev procesa sušenja v komercialnih in industrijskih slikah.
- Iz stroncijskega hidroksida dobimo soli ali stroncijeve ione, ki se uporabljajo kot surovina za proizvodnjo pirotehničnih člankov.
Reference
- Wikipedija (n.d.). Stroncijev hidroksid. Pridobljeno iz.Wikipedija.org
- Pubchem (s.F.). Stroncijev hidroksid. Pridobljeno iz PubChem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Honeywell (s.F.). Oktahidrat s stontion hidroksid. Pridobljeno iz Honeywella.com

