Amonijev hidroksid
- 1570
- 80
- Dexter Koch
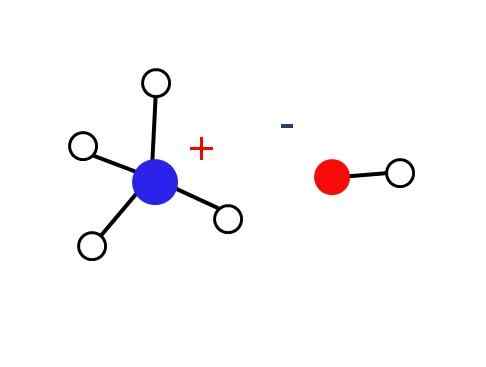
 Elektrostatična interakcija amonijevih in vodnih ionov. Vir: Gabriel Bolívar
Elektrostatična interakcija amonijevih in vodnih ionov. Vir: Gabriel Bolívar Kaj je amonijev hidroksid?
On Amonijev hidroksid To je NH molekularna formula4Oh oh5Ne to ne nastane z raztopino amonijskega plina (NH3) V vodi. Zaradi tega prejme imena tekočega amoniaka ali amoniaka.
Je brezbarvna tekočina in zelo intenziven in oster, ne izoliran vonj. Te značilnosti imajo neposreden odnos s koncentracijo NH3 Raztopljeno v vodi, koncentracija, ki lahko pokrije ogromne količine amoniaka, raztopljenega v malo volumna, saj je plin.
Bistveno majhen del teh vodnih raztopin je sestavljen iz NH kationov4+ In oh anioni-.
Po drugi strani pa lahko amonijak v obliki hidratov v zelo razredčenih raztopinah ali v zamrznjenih trdnih snovi pri zelo nizkih temperaturah najdemo amoniak3∙ h2Ali, 2nh3∙ h2Ali in nh3∙ 2H2Tudi.
Kemična struktura amonijevega hidroksida
Amonijev hidroksid je sestavljen iz vodne raztopine amoniaka. Zato znotraj tekočine ni določene strukture, ki ni naključno odstranjevanje NH ionov4+ in oh- Sotorjene z molekulami vode.
Amonijevi in hidroksilni ioni sta produkt amoniaka hidrolize, zato je običajno, da imajo te rešitve prodorni vonj:
Nh3(g) + h2Ali (l) nh4+(AC) + OH-(AC)
Glede na kemično enačbo bi veliko zmanjšanje koncentracije vode izpodrinilo ravnotežje na najbolj amoniako.
Zaradi tega so NH ioni4+ in oh- V kopenskih pogojih ne oblikujejo kristala, kar ima za posledico trdno bazo NH4Oh ne obstaja.
Omenjena trdna trdnost mora biti sestavljena samo iz ionov, ki elektrostátično delujejo (kot je razvidno iz slike).
Fizikalne in kemijske lastnosti
Molekularna formula
Nh4Oh oh5Ne
Molekularna teža
35.046 g/mol
Vidik
Brezbarvna tekočina.
Koncentracija
Do približno 30% (za NH ione4+ in oh-).
Vonj
Zelo močan in oster.
Okus
Hektar.
Mejna vrednost
34 ppm za nespecifično odkrivanje.
Vrelišče
38 ° C (25%).
Topnost
Obstaja samo v vodni raztopini.
Topnost vode
Mešan v neomejenih razmerjih.
Gostota
0,90 g/cm3 pri 25 ° C.
Gostota pare
Glede na zrak, ki je bil vzet kot enota: 0.6. To pomeni, da je manj gost kot zrak. Vendar pa logično prijavljena vrednost navaja amonijak kot plin, ne pa njenih vodnih raztopin ali NH4Oh.
Vam lahko služi: dipolarni trenutek: kako se izračuna in primeriParni tlak
2.160 mmHg pri 25 ° C.
Jedko delovanje
Lahko raztopi cink in baker.
ph
11.6 (rešitev 1 n); 11.1 (raztopina 0,1 N) in 10,6 (raztopina 0,01 n).
Konstanta disociacije
Pkb = 4.767; Kb = 1,71 x 10-5 pri 20 ° C
Pkb = 4.751; Kb = 1,774 x 10-5 pri 25 ° C
Povišanje temperature skoraj neopazno poveča bazičnost amonijevega hidroksida.
Nomenklatura
NH4Oh prejme skupna in uradna imena v skladu z določbami IUPAC. Njegovo ime je amonijev hidroksid za vsebovanje hidroksilnega aniona.
Amonij za njegovo +1 obremenitev je monovalent, zato je uporaba nomenklature zalog poimenovana kot amonijev hidroksid (i).
Toda uporaba "amonijevega hidroksida" je tehnično napačna, ker spojina ni izolabilna (vsaj ne na zemlji, kot je razloženo v prvem razdelku).
Prejema tudi tekoči amoniak in vodna imena amoniaka.
Topnost
Kot NH4Oh ne obstaja kot sol v kopenskih pogojih, ni mogoče oceniti, kako topna je v različnih topilih.
Vendar bi pričakovali, da bo v vodi izjemno topen, saj bi njegovo raztapljanje sprostilo ogromno NH3.
Teoretično bi bil neverjeten način za shranjevanje in prevoz amoniaka.
V drugih topilih, ki lahko sprejmejo vodikove mostove, kot so alkoholi in amini. Tukaj kation nh4+ Je darovalec vodikovih mostov in oh- Financirata kot oba.
Primeri teh interakcij z metanolom bi bili: H3N+-H - Ohch3 in ho- - Hoch3 (Oh3 Kaže, da kisik prejme vodikov most, ne pa, da je metilna skupina povezana s H).
Tveganja
- V stiku z očmi povzroči draženje, kar lahko privede do očesne poškodbe.
- Je jedko. Zato lahko v stiku s kožo povzroči draženje in pri visokih koncentracijah reagenta povzroči opekline kože. Ponavljajoči stik amonijevega hidroksida s kožo lahko povzroči njegovo suhost, srbenje in pordelost (dermatitis).
- Vdihavanje rosa amonijevega hidroksida lahko povzroči akutno draženje dihalnega trakta, za katerega je značilna zadušitev, kašelj ali pomanjkanje zraka.
- Dolgotrajna ali večkratna izpostavljenost snovi lahko povzroči ponavljajoče se okužbe bronhijev. Prav tako lahko vdihavanje amonijevega hidroksida povzroči draženje pljuč.
Vam lahko služi: stroncijev hidroksid (sr (OH) ₂)- Izpostavljenost visokim koncentracijam amonijevega hidroksida bi lahko pomenila medicinsko pomoč, saj se lahko v pljučih pojavi kopičenje tekočine (pljučni edem).
- Koncentracija 25 ppm je bila sprejeta kot meja izpostavljenosti v 8 -urni delovni premiki v okolju, kjer je delavec izpostavljen škodljivemu delovanju amonijevega hidroksida.
Reaktivnost
Poleg potencialne zdravstvene škode zaradi izpostavljenosti amonijeve hidroksida obstajajo tudi druge nege, ki jih je treba upoštevati pri delu s snovjo.
- Amonijev hidroksid lahko reagira s številnimi kovinami, kot so: srebro, baker, svinec in cink. Prav tako reagira s soli teh kovin, da tvori eksplozivne spojine in sprošča vodikov plin, ki je vnetljiv in eksploziven.
- Na primer lahko silovito reagira z močnimi kislinami: klorovodikovo kislino, žveplovo kislino in dušično kislino. Prav tako reagira na enak način z dimetil sulfatom in halogeni.
- Reagira z močnimi osnovami, kot sta natrijev hidroksid in kalijev hidroksid, ki proizvaja plinasti amonijak. To je mogoče preveriti, če opazimo ravnotežje v raztopini, v katerem dodajanje OH ionov- izpodriva ravnotežje na tvorbo NH3.
- Kovine bakra in aluminija ne smete uporabljati, pa tudi drugih pocinkanih kovin, ko se manipulira z amonijevim hidroksidom, zaradi korozivnega delovanja na njih.
Prijave
V hrani
- Uporablja se kot dodatek v mnogih živilih, v katerih izpolnjuje funkcije ležečega sredstva, nadzor nad pH in povzročiteljem površine hrane.
- Seznam živil, v katerih se uporablja amonijev hidroksid, je obsežen in vključuje pečene izdelke, sire, čokolade, bombone in pudine.
- Amonijev hidroksid s FDA za predelavo hrane katalogizira kot neškodljivo snov, pod pogojem, da se upoštevajo ustaljene norme.
- V mesnih izdelkih se uporablja kot protimikrobno sredstvo, saj lahko odpravi bakterije, kot so In. coli, zmanjšanje na neopazne ravni. Bakterijo najdemo v črevesju goveda, ki se prilagaja kislemu okolju. Amonijev hidroksid pri uravnavanju pH ovira rast bakterij.
Terapevtiki
Amonijev hidroksid ima med njimi več terapevtskih namenov:
- 10% raztopina se uporablja kot dihalni refleksni stimulansi.
Lahko vam služi: alfa-zotoglutarate: lastnosti, funkcije in aplikacije- Zunaj se uporablja na koži za zdravljenje žuželk in grižljajev.
- V prebavnem sistemu deluje kot antacidno in karminativno, to je, da pomaga odpraviti pline.
- Uporablja se kot aktualna guma. Zaradi tega dejanja se lokalno povečuje pretok krvi, pordelost in draženje.
Industrijski in različni
- Deluje v redukcijo NOX (zelo reaktivni plini, kot sta dušikov oksid (NO) in dušikov dioksid (št2)) Za emisije akumulatorja in zmanjšanje NOX v dimniških emisijah.
- Uporablja se kot plastično sredstvo, aditiv slik in za obdelavo površin.
- Poroznost las se poveča, kar omogoča večjo penetracijo, kar dosega boljši zaključek.
- Amonijev hidroksid se uporablja kot protimikrobno sredstvo pri čiščenju odpadne vode. Poleg tega posega v sintezo kloramina. Ta snov izpolnjuje funkcijo klora pri čiščenju bazenske vode, ki ima prednost, da je manj strupena.
- Uporablja se kot zaviralec korozije v postopku rafiniranja olja.
- Uporablja se kot čistilno sredstvo v različnih industrijskih in komercialnih izdelkih, ki se uporablja na več površinah, vključno z nerjavnim jeklom, porcelanom, steklom in pečicami.
- Uporablja se pri proizvodnji detergentov, mil, farmacevtskih izdelkov in črnil.
V kmetijstvu
- Čeprav se ne daje neposredno kot gnojilo, amonijev hidroksid izpolnjuje to funkcijo. Amonijak se pojavlja iz atmosferskega dušika po načinu, kako imeti Bosch in se prenaša hladilno pod njeno vrelišče (-33 ° C) na mestih njegove uporabe.
- Amonijak pod tlakom se vbrizga v obliki pare, znotraj zemlje, kjer takoj reagira z edafično vodo in prehaja v obliko amonija (NH4+), ki se zadržuje na mestih kacionalnih izmenjav tal. Poleg tega se pojavi amonijev hidroksid. Te spojine so vir dušika.
- Skupaj s fosforjem in kalijem dušik predstavlja glavno triado hranil bistvenih rastlin za njihovo rast.
Reference
- Čelada, Anne Marie, ph.D. Dejstva o amonijevem hidroksidu. Opomogel od Thoughtco.com
- Informacijski list o nevarnih snovi: amonijev hidroksid [PDF]. Okreval od NJ.Gov
- Amonijev hidroksid. Okrevano od Chemistrylearner.com

