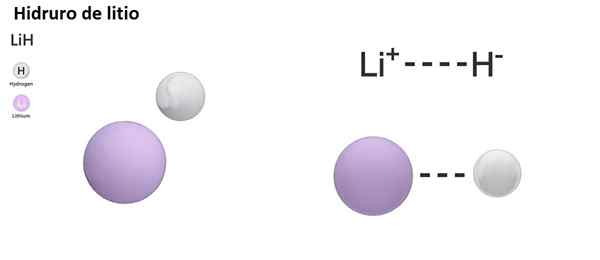Hidrorji
- 3441
- 679
- Lee Farrell
Kaj so Hydruros?
Hydros so kemične spojine, ki so posledica reakcije vodika s kovinskimi elementi (natrij, kalij, kalcij itd.) in ne kovine (klor, fluor, kisik, dušik, ogljik itd.). Vodik reagira s skoraj vsemi kemičnimi elementi, zato so hidrorji zelo raznolike snovi.
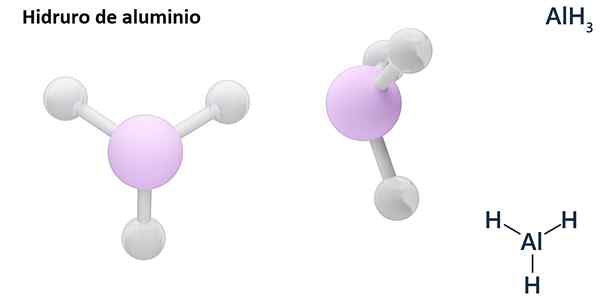
Njene splošne formule so lahko vrsta MHn, Kjer je m kovina in n Njegova Valencia (+1, +2, +3), na primer aluminijasti hidrid, ALH3; ali tipa EHn ali hnIn tam, kjer je E nemetalni element in n Njena valencia, kot NH3 ali h2S.
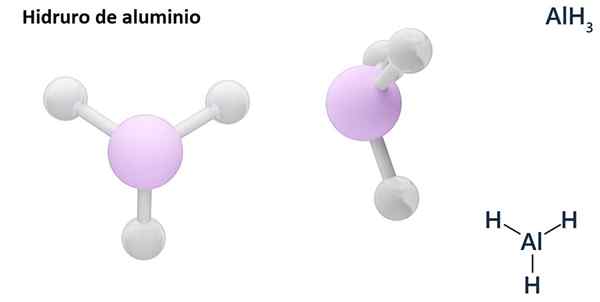
Hydros so običajno binarne spojine, to je, da so posledica kombinacije vodika z drugim kemičnim elementom. Vendar pa lahko vodik vzpostavi tudi kombinacije z več kemičnimi elementi, da tvori bolj zapletene hidrorje. Vsi pojasnjeni hidrorji bodo binarni, na primer ALH3 in ne.
Obstajajo tri vrste hidrorjev glede na naravo njegove kemične vezi: ionska, molekularna in kovinska. Za ionske ali fiziološke hidrorje je značilna prisotnost ionske vezi. Ta povezava je sestavljena iz električne privlačnosti med pozitivno obremenitvijo alkalne kovine (NA+) ali alkalni-sunkov (mg2+) in negativna obremenitev hidridnega aniona (h-).
Na drugi strani je značilna molekularna hidrida s tvorbo kovalentne vezi med vodikom in ne -metalnim elementom. Med nemetalnimi elementi, ki tvorijo hidros, so: klor, bromin, fluor, jod, kisik in dušik.
In kovinski hidrorji so posledica kombinacije vodika z nekaterimi prehodnimi kovinami. Ta vrsta hidridov, za razliko od prejšnjih, imajo zapletene strukture in tukaj ne bodo pojasnjeni.
Hydrosove lastnosti
Lastnosti hirurn se razlikujejo glede na vrsto hidrida: ionske, molekularne ali kovinske, zato morajo biti njihove lastnosti navedene ločeno.
Ionski ali fiziološki hidrorji
So kristalne bele trdne snovi, vendar zaradi prisotnosti nečistoč pridobijo sivkasto barvo. Ti hidridi niso topni v skupnih topilih, kot so voda, alkohol itd. Imajo tudi visoke vrele in fuzijske točke.
Imajo visoko in staljeno gostoto države lahko izvaja elektriko.
Ionski hidurni veljajo za osnovni ali alkalni, saj so raztopljeni v vodi hidroksidov in sproščajo molekularni vodik:
Nah +h2O → h2 + Naoh
Reakcija ionskega hidrida z vodo je zelo živahna in nevarna: povzroči vodik v plinski obliki, ki je gorljiv in vnetljiv material.
Ionski hidurki lahko reagirajo tudi s kovinskimi halogedi, ki jih tvorijo kovina, in ne -metal, znano kot halogen (Mx, x = F, Cl, Br, i):
Vam lahko služi: dimetilanil: struktura, lastnosti, sinteza, uporaba4 lih +alcl3 → Lialh4 + 3 licl
Lih (litijev hidrid) je binarna spojina; medtem ko je lialh4 (Litij in aluminijev hidrid) je Ternarna spojina, torej je sestavljena iz treh kemičnih elementov.
Molekularni ali kovalentni hidrosi
So v tekočem ali plinastem stanju za razliko od ionskih hidrorjev, ki so trdni. Imajo nizke vrele in fuzijske točke, pri čemer opazujejo, da se s povečanjem molekulske mase hidrida poveča točka vrelišča; Razen amoniaka (NH3), Voda (h2O) in fluorid hidrid (HF).
Kovalentni hidridi so slabi električni vodniki in številne njihove lastnosti so posledica tvorbe vodikovih mostov. Kovalentni hidridi veljajo za kisline, saj lahko raztopljeni v vodi povzročijo kisline, na primer klorovodikovo kislino.
Kovinski hidrorji
So v trdnem stanju in predstavljajo temni ton kovin. So dobri elektroenergetski prevodniki in imajo sijoče površine. Kovinski hidridi, ki so stabilni v zraku, postanejo reagenti, ko se segrejejo, na primer uranski hidrid (uh3) Predstavite to lastnost.
Nomenklatura
Način za poimenovanje hidrorjev je preprost in se v nobeni od nomenklatura ne razlikuje preveč. Če ima kovinska kovina ali element več kot eno valenco, je določena v oklepajih in z rimsko številko glede na nomenklaturo zalog.
Na primer feh3 se imenuje železni hidrid (III) in COH2 Kobalt hidro (ii). Te iste hidride je mogoče imenovati tudi s sistematično nomenklaturo, ki uporablja grške številke (DI, Tri, Tetra itd.). Tako feh3 se imenuje železni trihidrid in coh2 kobalt dihruro.
Klasična nomenklatura se ne uporablja za hidros. Nah na primer je znan bolj kot natrijev hidrid in ne natrijev hidrid.
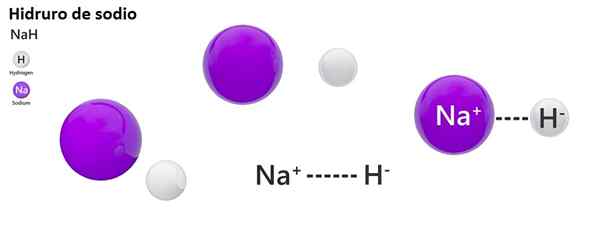 Natrijev hidrid
Natrijev hidrid Kako nastanejo hidrosi?
Ionski ali fiziološki hidrorji
Nastajajo z reakcijo vodika s kovino, ki pripada skupini alkalnih kovin ali skupine alkalno-Terrero kovin.
V hidrorjih, usposobljenih s temi kovinami, vodik najdemo v obliki H-, znan kot hidrid anion.
Alkalne kovine (litij, natrij, kalij, rubidij in cezij) reagirajo z vodikom, da tvorijo ustrezne hidurne:
2 m (l)+h2(g) → 2MH (s)
Vam lahko služi: operacije enoteKovina M Pri reakciji je v tekočem stanju in vodik v plinastem stanju, zato reakcija zahteva visoke temperature in visoke tlake. Razmislite o naslednjem primeru:
2 li (l) +h2 (g) → 2 lih (s)
Reakcija vodika z alkalnimi tretjimi kovinami (berilij, magnezij, kalcij, stroncij in barij) je za tvorbo hidridov podobna kot pri alkalnih kovinah, ki jih opazimo.
Magnezij in berilij tvorita hidride, vendar so njihove vezi z vodikom kovalentnega tipa; Se pravi, ne -iionski, za razliko od drugih alkalnih kovin:
Ca (l) +h2 (g) → CAH2 (S)
Molekularni hidrorji
Vodik lahko reagira z ne -komelami, ki ustrezajo skupinam 14, 15, 16 in 17 periodične tabele, da tvori molekulske hidrorje. Razmislite na primer nastajanje fluoridnega hidrida s kombinirano ali neposredno mešanico vodika s fluorom:
H2 (g) +f2 (g) → 2 HF (g)
HF je znan bolj kot vodikov fluorid, vendar se imenuje tudi fluoridni hidrid.
Tudi vodik lahko reagira s kisikom (skupina 16 periodične tabele) po isti shemi:
2 h2 (g) +oz2 (g) → 2 h2O (g)
Reakcija zahteva oskrbo s toploto, da nastane vodikov oksid (voda) ali hidrid kisika.
Tudi vodik lahko reagira z dušikom, ki pripada skupini 15 periodične tabele, da tvori dušikov hidrid, bolj znan kot amonijak (NH3).
N2 (g) +3 h2 (g) → 2 NH3 (g)
Reakcija zahteva oskrbo s toploto, visok tlak in prisotnost katalizatorjev (pospešujejo kemične reakcije).
Kovinski hidrorji
Nastajajo z reakcijo prehodnih kovin (skupine 3, 4, 5, 6, 10, 11 in 12 periodične tabele) z vodikom. Vendar prehodne kovine skupin 7, 8 in 9 ne tvorijo spojin z vodikom, pojavom, znanim kot hidridni vrzel ali vrzel hidrid.
Edinstvena značilnost prehodnih kovinskih hidrorjev je, da ne predstavljajo vedno fiksnega deleža med številom vodikovih atomov in številom atomov, ki so prisotni v hidridu. To pomeni, da njihove formule in strukture niso preproste.
Uporaba/aplikacije hidrosov
 Hydros so zelo prisotni v eni od številnih vrst baterij: kot nimh. Vir: Multicherry, CC by-SA 4.0, prek Wikimedia Commons
Hydros so zelo prisotni v eni od številnih vrst baterij: kot nimh. Vir: Multicherry, CC by-SA 4.0, prek Wikimedia Commons Hydros so prisotni v nikljevih kovinskih hidridnih baterijah (NIMH), ki se uporabljajo skupaj z redkimi zemeljskimi kovinami, kobaltom ali manganom. Za uporabo v električnih avtomobilih, ki jih poganjajo vodik, je bilo pregledanih več kovinskih hidrorjev.
Lahko vam služi: metoda redox ravnovesja: koraki, primeri, vajeZmanjševanje sredstev
Litijev hidrid in natrijev boron (NABH4) Uporabljajo se kot kemijske reakcije v reakcijah organske sinteze.
Shranjevanje vodika in druge povezane uporabe
Obstajajo piloti uporabe vodika kot gorivo v motornih vozilih, vendar je bila zaradi njegove eksplozivnosti njegova uporaba omejena kot gorivo. Uporaba hidrosov je bila predlagana kot oblika skladiščenja vodika, da bi tako nadzirali njihovo nevarnost.
Poleg tega so bili hidrorji uporabljeni za čiščenje in ločevanje senzorjev vodika in temperature.
Sušilci
Kalcijev hidrid se uporablja za odstranjevanje vode, ki je prisotna v organskih topilih.
Kisline izvirajo z molekularnimi hidrorji
Na primer: klorovodikova kislina nastane z raztopino v vodnem mediju klora hidrida (HCl) z uporabo klorovodikove kisline pri izločanju oksidov, ki pokrivajo železo, zakisanje oljnih vrtin, proizvodnja klorida kalcija in mineralov.
Gnojila
Amoniak (NH3) Gre za hidrid, ki se uporablja kot tekoče gnojilo in služi za sintezo spojin z amonijevim nitratom in amonijevim sulfatom, ki se uporabljajo kot gnojila.
Voda
Je najpomembnejši hidrid. Uporablja se v številnih panogah z različnimi uporabami in aplikacijami. Voda je glavna odgovorna za obstoj živih bitij.
Primeri hidrorjev
Končno bodo drugi primeri hidrorjev navedeni s svojimi formulami in imeni:
Snh4: kositer hidrid | PH3: fosfor hidrid (fosfin) ali fosfor trihidrid |
KH: svinčni hidrid | MGH2: magnezijev hidrid ali magnezij dihdruro |
KH: kalijev hidrid | CH4: Carruro Carruro ali ogljikov tetrahidrid (metan) |
CAH2: kalcijev hidrid | Feh2: železni hidrid (ii) |
Ne: natrijev hidrid | Znh2: cinkov hidrid |
Lih: litijev hidrid | Bah2: barijev hidrid |
CSH: Cezijev hidrid | BH3: BORON HYDRO (BAS |
Beh2: Beryl ali Beryl dihidrid hidrid | SIH4: Silicon Hydro (Silan) |
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wojes, Ryan. (27. avgust 2020). Kaj je kovinski hidrid? Okreval od: Thoughtco.com
- Ameriški elementi. (2020). Hidrididi. Pridobljeno od: Americanments.com
- Wikipedija. (2020). Hidrid. Pridobljeno iz: v.Wikipedija.org
- Tandis Arani. (15. avgust 2020). Hidrididi. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Uredniki Enyclopeedia Britannica. (2020). Hidrid. Okrevano od: Britannica.com