Litijeva hidridna struktura, lastnosti, pridobivanje, uporabe
- 2538
- 99
- Don Nitzsche
On Litijev hidrid Gre za kristalno anorgansko trdno snov, katere kemična formula je lih. Je najbolj lahka anorganska sol, njegova molekulska teža je le 8 g/mol. Oblikova ga zveza litij iona li+ in hidrid h ion-. Oba sta združena z ionsko vezjo.
Lih ima visoko tališče. Zlahka reagira z vodo in v reakciji se pojavi vodikov plin. Dobimo ga lahko z reakcijo med staljeno litijevo kovino in vodikovim plinom. V kemičnih reakcijah se pogosto uporablja za pridobivanje drugih hidrorjev.
 Litijev hidrid, lih. Noben strojno berljiv avtor ni zagotovil. Predvideva JTIAGO (na podlagi zahtevkov za avtorske pravice). [Javna domena]. Vir: Wikimedia Commons.
Litijev hidrid, lih. Noben strojno berljiv avtor ni zagotovil. Predvideva JTIAGO (na podlagi zahtevkov za avtorske pravice). [Javna domena]. Vir: Wikimedia Commons. LIH je bila uporabljena za zaščito pred nevarnim sevanjem, kot so tisti, ki jih najdemo v jedrskih reaktorjih, to so, alfa, beta, gama sevanje, protoni, x -roji in nevtroni.
Predlagana je bila tudi za zaščito materialov vesoljskih raket, ki jih premika jedrski toplotni pogon. Študije se celo uporabljajo kot zaščita človeka pred kozmičnim sevanjem med prihodnjimi potovanji na planet Mars.
[TOC]
Struktura
V litijevem hidridu ima vodik negativno obremenitev h-, No, elektron je ukradel kovino, ki je v obliki ion li+.
Elektronska kationska konfiguracija li+ Je: [on] 1s2 ki je zelo stabilen. In elektronsko strukturo hidrida h- Je: 1s2, ki je tudi zelo stabilen.
Kation in anion se vežeta z elektrostatičnimi silami.
Kristal litijevega hidrida ima enako strukturo kot natrijev klorid, to je kubična kristalna struktura.
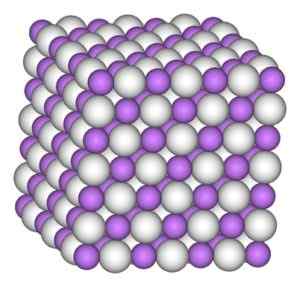 Kubična kristalna struktura litijevega hidrida. Avtor: Benjah-BMM27. Vir: Wikimedia Commons.
Kubična kristalna struktura litijevega hidrida. Avtor: Benjah-BMM27. Vir: Wikimedia Commons. Nomenklatura
- Litijev hidrid
- Lih
Lastnosti
Fizično stanje
Bela ali brezbarvna kristalna trdna. Komercialna lih je lahko sivkasto modra zaradi prisotnosti majhnih količin litijeve kovine.
Molekularna teža
8 g/mol
Tališče
688 ° C
Vrelišče
Razpade pri 850 ° C.
Temperatura samostojnosti
200 ° C
Gostota
0,78 g/cm3
Topnost
Reagirati z vodo. Je netopna v etrih in ogljikovodikih.
Druge lastnosti
Litijev hidrid je veliko bolj stabilen kot hidros drugih alkalnih kovin in ga je mogoče brez razpadanja.
Vam lahko postreže: suha baterijaNanj ne vpliva kisik, če se segreje pri temperaturah pod rdečo. Prav tako na to ne vpliva klor2 in HCl klorovodikova kislina.
Stik LIH s toploto in vlago povzroči eksotermično reakcijo (ustvarja toploto) in evolucijo vodika H2 in litijev hidroksid lioh.
Lahko tvori lep prah, ki lahko izkorišča stik s plameni, toploto ali oksidacijskimi materiali. Ne smete vzpostaviti stika z dušikovim oksidom ali tekočim kisikom, saj lahko izkorišča ali vklopi.
Zatemni tako, da je izpostavljen svetlobi.
Pridobivanje
Litijev hidrid je bil v laboratoriju pridobljen z reakcijo med staljeno litijevo kovino in vodikovim plinom pri temperaturi 973 K (700 ° C).
2 Li + H2 → 2 lih
Dobri rezultati dobimo, ko se poveča izpostavljena površina staljenega litija in ko se čas sedimentacije LIH skrajša. Gre za eksotermično reakcijo.
Uporabljam kot zaščitni ščit pred nevarnim sevanjem
Lih predstavlja vrsto značilnosti, zaradi katerih je privlačna kot zaščita za človeka v jedrskih reaktorjih in vesoljskih sistemih. Tu je nekaj teh značilnosti:
- Ima visoko vsebnost vodika (12,68 % po teži H) in veliko število vodikovih atomov na enoto (5,85 x 1022 H/cm atomi3).
- Njegova visoka tališče omogoča uporabo v visokotemperaturnih okoljih, ne da bi bila ustanovljena.
- Ima nizki disociacijski tlak (~ 20 Torr na njegovem tališču), ki omogoča, da se material vrže in zamrzne, ne da bi se razgradil pod nizkim vodikovim tlakom.
- Ima nizko gostoto, zaradi česar je privlačna za uporabo v vesoljskih sistemih.
- Vendar so njihove pomanjkljivosti njihova nizka toplotna prevodnost in slabe mehanske lastnosti. Toda to ni zmanjšalo njegove uporabnosti.
- Kose lih, ki služijo kot ščiti, izdelujejo hladno ali vročo stiskanje in zlivanje in vlivanje v kalupe. Čeprav je prednostna ta zadnji obrazec.
- Pri sobni temperaturi so deli zaščiteni pred vodo in vodno paro.
- V jedrskih reaktorjih
V jedrskih reaktorjih obstajata dve vrsti sevanja:
Vam lahko služi: kisline in baze v vsakdanjem življenju: reakcije, uporabe, primeriNeposredno ionizirajoče sevanje
So zelo energetski delci, ki nosijo električni naboj, kot so alfa (α) in beta (β) in delci protonov. Te vrste sevanja zelo močno vplivajo na materiale ščiti, kar povzroča ionizacijo pri interakciji z elektroni materialov, skozi katere prehajajo.
Posredno ionizirajoče sevanje
So nevtroni, gama žarki (γ) in x -rays, ki prodirajo in potrebujejo maso zaščite, saj vključujejo oddajanje naloženih sekundarnih delcev, ki so tisti, ki povzročajo ionizacijo.
 Simbol, da opozori na nevarno sevanje. IAEA & ISO [javna domena]. Vir: Wikimedia Commons.
Simbol, da opozori na nevarno sevanje. IAEA & ISO [javna domena]. Vir: Wikimedia Commons. Po nekaterih virih je LIH učinkovita pri zaščiti materialov in ljudi pred temi vrstami sevanja.
- V jedrskem toplotnem pogonskem prostoru
LIH je bila pred kratkim izbrana za potencialno moderator in zaščitni material pred jedrskim sevanjem za jedrske toplotne pogonske sisteme vesoljskega plovila za zelo dolgo potovanja.
 Umetniška predstavitev vesoljskega vozila z jedrskim pogonom v orbiti Marsa. NASA/SAIC/PAT RAWLINGS [javna domena]. Vir: Wikimedia Commons.
Umetniška predstavitev vesoljskega vozila z jedrskim pogonom v orbiti Marsa. NASA/SAIC/PAT RAWLINGS [javna domena]. Vir: Wikimedia Commons. Njegova nizka gostota in visoka vsebnost vodika povzročita, da se masa in prostornina reaktorja jedrskega pogona učinkovito zmanjšata.
- V zaščito pred kozmičnim sevanjem
Izpostavljenost vesoljskemu sevanju je najpomembnejše tveganje za zdravje ljudi v prihodnjih medplanetarnih misijah.
V globokem prostoru bodo astronavti izpostavljeni celotnemu spektru galaktičnih kozmičnih žarkov (visoko energetskih ionov) in dogodkov iz izmel sončnih delcev (protoni).
Nevarnost izpostavljenosti sevanju se poslabša zaradi trajanja misij. Poleg tega je treba upoštevati tudi zaščito krajev, ki jih je treba upoštevati.
 Prihodnja simulacija habitata na planetu Mars. NASA [javna domena]. Vir: Wikimedia Commons.
Prihodnja simulacija habitata na planetu Mars. NASA [javna domena]. Vir: Wikimedia Commons. V tem vrstnem redu idej je študija, izvedena leta 20182, Zato je eden najboljših kandidatov, ki jih je treba uporabiti pri zaščiti pred kozmičnim sevanjem. Vendar je treba te študije poglobiti.
Uporabljam kot sredstvo za shranjevanje in varen prevoz vodika
Pridobivanje energije iz h2 To je nekaj, kar se že več deset let preučuje in je že našel uporabo za nadomeščanje fosilnih goriv v prometnih vozilih.
Vam lahko služi: kemično ravnovesje: razlaga, dejavniki, vrste, primeriH2 Uporablja se lahko v gorivnih celicah in prispeva k zmanjšanju ko -proizvodnje2 in nex, s čimer se izognemo učinku in onesnaževanju toplogrednih plinov. Vendar učinkovit sistem za shranjevanje in prevoz H še ni bil najden2 Zagotovo, z lahkotno, kompaktno ali majhno težo, ki jo hitro vodi in sprosti H2 enako hitro.
Lih litijev hidrid je iz alkalnih hidrorjev, ki imajo najvišjo zmogljivost skladiščenja H2 (12,7 % po teži H). Sprostitev H2 s hidrolizo v skladu z naslednjo reakcijo:
Lih + H2O → lioh + h2
LIH oskrbuje 0,254 kg vodika za vsak kg LIH. Poleg tega ima visoko prostornino skladišča na enoto, kar pomeni, da je lahek in je kompakten medij za H shranjevanje H2.
 Motocikel, katerega gorivo je vodik, shranjen v obliki kovinskega hidrida, kot je Lih. Ali.S. DOE ENERGION Učinkovita in obnovljiva energija (ZDA) [javna domena]. Vir: Wikimedia Commons.
Motocikel, katerega gorivo je vodik, shranjen v obliki kovinskega hidrida, kot je Lih. Ali.S. DOE ENERGION Učinkovita in obnovljiva energija (ZDA) [javna domena]. Vir: Wikimedia Commons. Poleg tega se LIH lažje tvori kot drugi alkalni kovinski hidrorji in je kemično stabilna pri okoljskih temperaturah in pritiskih. LIH se lahko prevaža iz proizvajalca ali dobavitelja do uporabnika. Potem se s hidrolizo liH ustvari h2 In to se varno uporablja.
Lioh litijev hidroksid lahko vrnemo dobavitelju, ki z elektrolizo regenerira litij, nato pa ponovno ustvari LIH.
LIH je bil uspešno preučen, da se skupaj z drznim hidrakom uporablja za isti namen.
Uporaba v kemičnih reakcijah
LIH omogoča kompleksno sintezo hidrorjev.
Služi na primer za pripravo litijevega trietilborohidrida, ki je močan nukleofil v reakcijah organskih haluros.
Reference
- Sato in. In Takeda ali. (2013). Sistem za shranjevanje in prevoz vodika prek litijevega hidrida z uporabo tehnologije staljene soli. V kemiji staljenih soli. Poglavje 22, strani 451-470. Okrevano od Scientirect.com.
- Ali.S. Nacionalna knjižnica medicine. (2019). Litijev hidrid. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Wang, l. et al. (2019). Preiskava vpliva themalno-jerskega učinka lihijevega hidrida na reaktivno jedrsko. Anali jedrske energije 128 (2019) 24–32. Okrevano od Scientirect.com.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Giraudo, m. et al. (2018). Preskusi zaščite različnih materialov in večnamenskih testov na osnovi pospeševalnikov z uporabo visoko ergijskih lahkih in težkih ionov. Raziskave sevanja 190; 526-537 (2018). NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Welch, f.H. (1974). Litijev hidrid: vesoljski material za zaščito. Jedrski inženiring in oblikovanje 26, 3, februar 1974, strani 444-460. Okrevano od Scientirect.com.
- Simnad, m.T.(2001). Jedrski reaktorji: zaščitni materiali. V Enciklopediji materialov: Znanost in tehnologija (druga izdaja). Strani 6377-6384. Okrevano od Scientirect.com.
- Hügy, t. et al. (2009). Hydrazin Boran: obetaven shranjevanje vodika. J. A.M. Kem. Soc. 2009, 131, 7444-7446. Okrevani iz lokalov.Acs.org.
- « Amenadiel pomen, prisotnost v Bibliji in Luciferju
- Zgodovina majevske medicine, Bog, rastline, bolezni »

