Struktura aluminijevega hidrida (ALH3), lastnosti, uporabe
- 2244
- 127
- Adrian Legros
On Aluminijast hidrid To je anorganska spojina, katere kemijska formula je ALH3. Čeprav se zdi preprosta narava, je pravzaprav nekoliko zapletena snov. Zaradi kristalne svetlosti, ki se lahko pojavi v svoji trdni trdni snovi, jo običajno jemljemo kot ionski hidrid, ki ga tvorijo ioni v3+ in h-.
Vendar njegove lastnosti kažejo drugače: je polimerna trdna snov, katere najbolj zvesta reprezentacija bi bila tipa (ALH3)n, biti n Število monomernih enot alh3 To bi integriralo stekleno verigo ali plast. Zato je alh3 To je eden tistih polimerov, ki uspe sprejeti kristalno strukturo.
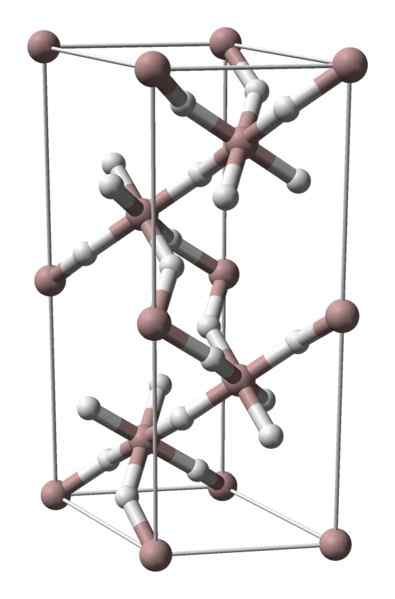 Kristalna struktura aluminijevega hidrida. Vir: Benjah-BMM27 / javna domena
Kristalna struktura aluminijevega hidrida. Vir: Benjah-BMM27 / javna domena Aluminijevi hidrid ni trden z veliko komercialne difuzije, zato so njene slike malo. Posebej se uporablja za organsko sintezo, kjer služi kot močno reducirajoče sredstvo. Prav tako zaseda posebno mesto v tehnološkem napredku materialov, ki je obetavna alternativa za shranjevanje vodika.
Ta spojina, imenovana tudi Alano, ohranja tesno razmerje z Lialhom4, katerih imena so aluminijev in litijev hidrid, litijev alanat ali litijev tetrahidroaluminacija. Čeprav ima značilnosti polimera in toplotno metastabilnost, se pojavlja v sedmih polimorfih z različnimi kristalnimi morfologijami.
[TOC]
Struktura
Koordinacije
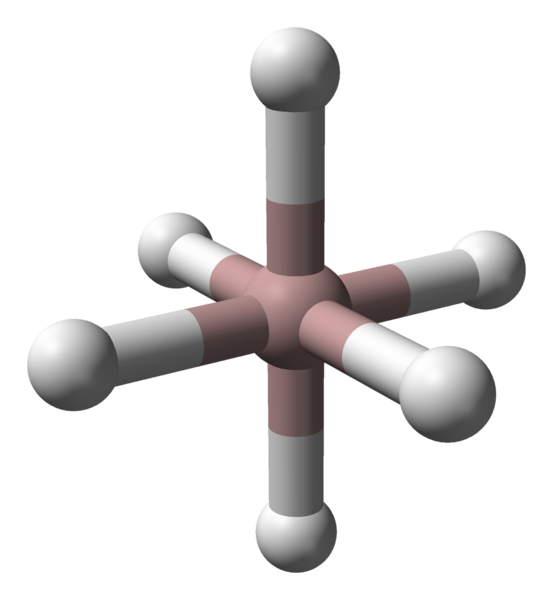
 Oktaedrska koordinacija aluminijastih kationov v kristalu ALH3. Vir: Benjah-BMM27 / javna domena.
Oktaedrska koordinacija aluminijastih kationov v kristalu ALH3. Vir: Benjah-BMM27 / javna domena. Ne glede na upoštevano polimorf ali kristalno fazo je koordinacija med aluminijem in vodikovim atomom konstantna. Na zgornji sliki je na primer, tako kot na prvi sliki, koordinacijski oktaedron za aluminijaste atome (rjava sfera) prikazan na prvi sliki.
Vam lahko služi: stehiometrični zakoniVsak atom je obkrožen s šestimi h, ki vzpostavi šest al-H povezav. Način, kako so oktaedre usmerjene v vesolje.
Po drugi strani je vsak atom H usklajen z dvema atoma AL, pri čemer vzpostavi vez Al-H-Al, ki bi jo lahko upravičil povezava tipa 3C2E (3 centri-2 elektroni). Ta povezava je odgovorna za pridružitev več Octaedros ALH6 V celotnem kristalu Alano.
Izolirana molekula
Alh3 Velja za polimerno zaradi omrežij ALH6 ki integrira kozarec. Za izolacijo posamezne molekule Alano je treba v inertni atmosferi plemenitega plina uporabiti nizke tlake. Na ta način polimer zlomi in sprošča molekule ALH3 trigonalne ravne geometrije (analogno BH3).
Po drugi strani je mogoče zmanjšati dva ALH3 oblikovati a2H6, Kot pri diboranu, b2H6. Vendar pa je za dosego to potrebna uporaba trdnega vodika, tako da morda nima veliko industrijske ali komercialne dolgoročne vrednosti.
Polimorfi
Alano ali alh3 Lahko tvori do sedem polimorfov: α, α ', β, γ, δ, ε in ζ, od katerih je α najbolj stabilen za temperaturne spremembe. Α-alh3 Odlikuje ga kubična morfologija in šesterokotno kristalno strukturo. Ponavadi je izdelek, v katerem se drugi polimorfi spreminjajo, ko trpijo toplotno destabilizacijo.
Morfologija γ-Alh3, Po drugi strani pa izstopa, da je tipa igel. Zato alh3 Trdna trdnost lahko vsebuje mešanico več kot dveh polimorfov in predstavlja raznolike kristale mikroskopu.
Lastnosti
Fizični videz
Aluminijevi hidrid je brezbarven ali belkast trden, kristalni videz s težnjo po prikazu igelnih oblik.
Vam lahko služi: sulfonska kislina: struktura, nomenklatura, lastnosti, uporabeMolarna masa
29.99 g/mol o 30 g/mol
Tališče
150 ° C. Vendar se začne razbiti od 105 ° C.
Topnost vode
Visoko, nato reagira z njo.
Topnost
Netopna v dietiléterskih in apolarnih topilih, kot sta benzen in pentan. Reagira z alkoholi in drugimi polarnimi topili.
Razgradnja
Alh3 Dovzetna je za razgradnjo pri različnih hitrostih, odvisno od zunanjih pogojev, morfologije in toplotne stabilnosti njihovih kristalov ali uporabe katalizatorjev. Ko to stori, sprošča vodik in se spremeni v kovinski aluminij:
2alh3 → 2Al + 3H2
Pravzaprav ta razgradnja in ne predstavlja problema, predstavlja enega od razlogov, zakaj Alano velja za zanimiv pri razvoju novih energetskih tehnologij.
Tvorba adduct
Ko je alh3 Ne reagira z topilom nepovratno, z njim vzpostavlja adukt, to je vrsta kompleksa. Na primer, lahko oblikujete kompleks s trimetilaminom, ALH3· 2n (Cho3)3, S tetrahidrofurano, alh3· Thf ali z dieteterjem, alh3· ET2Tudi. Slednji je bil najbolj znan, ko je bila sinteza ali pridobitev alano uvedena leta 1947.
Pridobivanje
Prvi nastopi ALH3 Izhajajo iz leta 1942 in 1947, lani, ko je bila njegova sinteza predstavljena z uporabo Lialha4 V dietilnem mediju:
3Lialh4 + Alcl3+ nEt2O → 4alh3 · nEt2O + 3licl
Eterična raztopina, ALH3 · nEt2Ali pa se je moral odločiti, da bi razočaral z namenom odprave ET2Ali in dobite alh3 Čisto. Poleg te težave je treba LICL izločiti iz medija izdelkov.
Tako je bila od leta 1950 do 1977 zasnovana nova sinteza za boljše donos ALH3, kot tudi najčistejše trdne snovi in boljše toplotne in morfološke lastnosti. Spreminjanje uporabljenih količin, korakov in instrumentov je mogoče nakloniti pridobivanju polimorfa nad drugo. Vendar α-Alh3 Običajno je to večinski izdelek.
Lahko vam služi: Alilo: Aluična enota, karbokacija, radikalni, primeriDruge metode sinteze so sestavljene iz uporabe elektrokemije. Za to se uporabljata aluminijasta anoda in platinasta katoda. V anodi mine naslednja reakcija:
3alh4- + Do3+ + nThf → 4alh3 · nThf + 3e-
Medtem ko v katodni kovinski natrij dobimo. Potem alh3 · nTHF se tudi razblini, da bi odpravil THF in končno pridobil ALH3.
Prijave
Zmanjšanje sredstva
Alh3 Služi za zmanjšanje nekaterih funkcionalnih skupin organskih spojin, kot so karboksilne kisline, ketoni, aldehidi in estri. Praktično, kar počne, je dodajanje vodikov. Na primer, lahko ster zmanjšamo na alkohol v prisotnosti nitro skupine:
 Zmanjšanje sterja z aluminijevim hidridom. Vir: ingver / javna domena.
Zmanjšanje sterja z aluminijevim hidridom. Vir: ingver / javna domena. Rezervoar vodika
Aluminijevi hidrid je alternativa, ki služi kot rezervoar vodika, in tako lahko, da ga lahko prenosno razprostirajo v napravah, ki delujejo z vodikovimi baterijami. Količine, pridobljene iz H2 ustreza večji količini dvojnega od ALH3.
Imeti alh3, in razgradnja nadzorovanega, lahko sprostimo določeno zaželeno količino H2 kadarkoli. Zato bi ga lahko uporabili kot raketno gorivo in vse tiste energijske aplikacije, ki želijo izkoristiti zgorevanje vodika.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Hidrid aluminij. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2020). Hidrid aluminij. Baza podatkov Pubchem., Cid = 14488. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- J. Graetz in sod. (2011). Aluminijevi hidrid kot gradivo za shranjevanje vodika in energije: preteklost, sedanjost in prihodnost. Elsevier b.V.
- Xu Bo et al. (2014). Priprava in toplotne lastnosti polimorfov študentskih hidridov. doi.org/10.1016/j.Vakuum.2013.05.009
- « Koncept linearne variacije, primeri, rešena vaja
- Zemeljska oblika in njegove fizične in astronomske posledice »

