Struktura hidrolazaze, funkcije, primeri

- 3797
- 285
- Raymond Moen
The Hidrolaza So encimi, ki so odgovorni za hidroliziranje različnih vrst kemičnih povezav v številnih različnih spojinah. Med glavnimi povezavami, ki so Hydrolyz, so ester, glukozidne in peptidne povezave.
V skupini hidrolaz je bilo razvrščenih več kot 200 različnih encimov, razvrščenih vsaj 13 posameznih sklopov; Njegova razvrstitev v bistvu temelji na vrsti kemične spojine, ki služi kot podlaga.
 Grafično modeliranje z bioinformatičnimi orodji strukture hidrolaze (vir: Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [Public Domain] prek Wikimedia Commons) prek Wikimedia Commons)
Grafično modeliranje z bioinformatičnimi orodji strukture hidrolaze (vir: Jawahar Swaminathan in MSD osebje na Evropskem inštitutu za bioinformatiko [Public Domain] prek Wikimedia Commons) prek Wikimedia Commons) Hidrolaze so nepogrešljive za prebavo hrane v črevesju živali, saj so odgovorne za razgradnjo velikega dela povezav, ki sestavljajo gazirane strukture živil, ki jih zaužijejo.
Ti encimi delujejo v vodnih medijih, saj potrebujejo molekule vode okoli sebe, da se spojine dodajo, ko se molekule razdelijo. Z preprostimi besedami hidrolaze izvajajo hidrolitno katalizo spojin, na katerih delujejo.
Na primer, ko hidrolaza prekine kovalentno vez C-C, je rezultat običajno skupina C-O in skupina C-H.
[TOC]
Struktura
Tako kot mnogi encimi so tudi hidrolaze organizirane kroglične beljakovine v zapletenih strukturah, ki so organizirane z intramolekularnimi interakcijami.
Hidrolaze, tako kot vsi encimi, vežejo na eno ali več molekul substrata v območju njegove strukture, ki je znana kot "aktivno mesto". To spletno mesto je žep ali razcep, obkrožen s številnimi aminokislinskimi ostanki, ki olajšajo oprijem ali združitev podlage.
Vsaka vrsta hidrolaze je specifična za dani substrat, ki ga določa njegova terciarna struktura, in tvorbo aminokislin, zaradi katerih je njihovo aktivno mesto. To specifičnost je Emil Fischer didaktično dvignil kot nekakšno "ključno in ključavnico".
Vam lahko služi: polimeraza: značilnosti, struktura in funkcijeTrenutno je znano, da substrat na splošno povzroči spremembe ali izkrivljanja pri tvorbi encimov in da encimi izkrivljajo strukturo podlage, da se zagotovi, da je ta "čipka" na svojem aktivnem mestu.
Funkcije
Vse hidrolaze imajo glavno funkcijo lomljenja kemičnih vezi med dvema spojinama ali znotraj strukture iste molekule.
Obstajajo hidrolaze, da zlomijo skoraj katero koli vrsto povezave: nekatere razgradijo ester vezi med ogljikovimi hidrati, drugimi peptidnimi vezmi med beljakovinskimi aminokislinami, drugimi karboksilnimi vezmi itd.
Namen procesa kemične vezi, ki ga katalizira encim hidrolaze. Smozyme je na primer odgovoren za hidrolizo kemijskih vezi z namenom zaščite organizma, ki jo sintetizirajo.
Ta encim razgradi povezave, ki se držijo skupaj s spojinami v celični steni bakterij, z namenom zaščite človeškega telesa pred bakterijsko proliferacijo in možno okužbo.
Nukleas so encimi fosfataze, ki lahko razgradijo nukleinske kisline, kar lahko predstavlja tudi celični obrambni mehanizem proti virusom DNK ali RNA.
Druge hidrolaze, kot so tipa "proteaze", razgradijo peptidne vezi beljakovin v prebavnem traktu.
Tudi hidrolaze so vključene v različne dogodke proizvodnje energije v celični presnovi, saj fosfataze katalizirajo sproščanje fosfatnih molekul iz visokoenergijskih substratov, kot je piruvat, v glikolizi.
Lahko vam služi: sojini oprijemPrimeri hidrolazaz
Med veliko raznolikostjo hidrolaz, ki so jih znanstveniki opredelili, so bili nekateri preučeni z večjim poudarkom kot drugi, saj so vključeni v številne bistvene procese za celično življenje.
Med njimi so gladkost, proteazni serin, endonuklezna in glukozidaza ali glikoziralna fosfataza.
Gladkost
Encimi te vrste prelomni. To običajno povzroči popolno lizo bakterij.
Smocimi branijo telo živali bakterijskih okužb in so v telesnih izločkih v tkivih, ki so v stiku z okoljem, na primer solze, sline in sluznice.
Gladko piščančje jajce je bila prva beljakovinska struktura, ki se je kristalizirala skozi x -roje. To kristalizacijo je leta 1965 naredil David Phillips na londonskem resničnem inštitutu.
Aktivno mesto tega encima je sestavljeno iz asparagin-alanin-mehanin-peasparagin-glicin-glicin-peptin-metionin peptid (NAM-NAG-NAM).
Proteaza serin
Encimi te skupine so odgovorni za hidroliziranje peptidnih vezi pri peptidih in beljakovinah. Najpogosteje raziskana sta trpsin in himotripsin; Vendar pa obstaja veliko različnih vrst proteaz, ki se razlikujejo glede na specifičnost substrata in njegovega mehanizma katalize.
Za "proteaze" je značilno, da ima nukleofilno aminokislino v tipu serina. Proteasas Serin lahko razbije tudi široko paleto esterskih povezav.
Vam lahko služi: kakšna je kemična sestava živih bitij?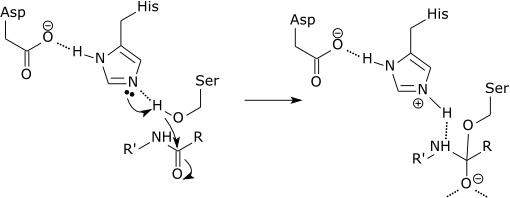 Grafična shema delovanja proteaze, ki razbija peptidno povezavo v aminokislini histidin (vir: Zephyris na angleškem jeziku Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/)] prek Wikimedia Commons)
Grafična shema delovanja proteaze, ki razbija peptidno povezavo v aminokislini histidin (vir: Zephyris na angleškem jeziku Wikipedia [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/)] prek Wikimedia Commons) Ti encimi režejo peptide in beljakovine na nespecifičen način. Vendar pa mora biti vse peptide in beljakovine, ki jih je treba odrezati, zavezati N-terminalni konec peptidne povezave do aktivnega mesta encima.
Vsaka kratka proteaza je natančno amida vez, ki tvori med C-terminalnim koncem aminokisline na karboksilnem koncu in amina amina, ki je proti N-terminalnemu koncu peptida.
Fosfataze nukleaze
Ti katalog encimov. Obstaja veliko različnih vrst teh encimov, saj so specifične za vrsto nukleinske kisline in mesta za rezanje.
 Grafična shema delovanja endonukleaze, ki hidrolizira fosfodiéstersko vez (vir: J3D3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons)
Grafična shema delovanja endonukleaze, ki hidrolizira fosfodiéstersko vez (vir: J3D3 [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons) Endonukleaze so nepogrešljive na področju biotehnologije, saj znanstvenikom omogočajo, da spreminjajo genome organizmov z rezanjem in nadomeščanjem fragmentov genetskih informacij skoraj katere koli celice.
Endonukleaze naredijo rezanje dušikovih baz v treh korakih. Prva je skozi nukleofilno aminokislino, nato se tvori vmesna struktura z negativno obremenitvijo, ki pritegne fosfatno skupino in končno prekine povezavo med obema bazama.
Reference
- Davies, g., & Henrissat, b. (devetnajst devetdeset pet). Strukture in mehanizmi glikozil hidrole. Struktura, 3 (9), 853-859.
- Lehninger, a. L., Nelson, d. L., Cox, m. M., & Cox, m. M. (2005). Lehningerjeva načela biokemije. Macmillan.
- Mathews, a. Str. (1936). Načela biokemije. W. Les.
- Murray, r. K., Granner, d. K., Mayes, str., & Rodwell, v. (2009). Harperjeva ilustrirana biokemija. 28 (str. 588). New York: McGraw-Hill.
- Ollis, d. L., Cheeah, e., Cygler, m., Dijkstra, b., Folow, f., Franken, s. M.,… & Sussman, j. L. (1992). Α/β hidrolazni pregib. Inženirski beljakovine, oblikovanje in izbira, 5 (3), 197-211.

