Hidroliza, kaj je sestavljeno, in primeri reakcij
- 1049
- 132
- Raymond Moen
The hidroliza To je kemična reakcija, ki se lahko pojavi tako v anorganskih in organskih molekulah ali ionih, ki vključuje sodelovanje vode za razpad njenih vezi. Njegovo ime izvira iz grščine, "hidro" vode in "lize" rupture.
Molekula vode, h2Ali pa vzpostavi ravnovesje z ioni kislih soli in šibkih baz, ki se prvič pojavlja ta koncept v splošnih študijah kemije in v analitični kemiji. Je torej ena najpreprostejših kemičnih reakcij.
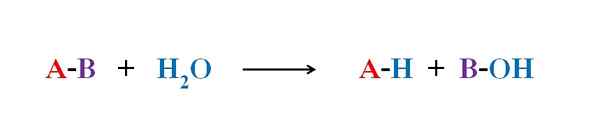 Splošna enačba za reakcijo hidrolize. Vir: Gabriel Bolívar.
Splošna enačba za reakcijo hidrolize. Vir: Gabriel Bolívar. V več primerih hidrolize sama voda ne more razbiti določene kovalentne vezi. Ko se to zgodi, postopek pospeši ali katalizira z zakisanjem ali alkalizacijo medija; to je v prisotnosti H ionov3Tudi+ ali oh-, oziroma. Obstajajo tudi encimi, ki katalizirajo hidrolizo.
Hidroliza zaseda posebno mesto v smislu biomolekul, saj so povezave, ki ohranjajo monomere skupaj. Na primer, sladkorji hidrolizirajo, da razgradijo polisaharide v njihovih sestavnih monosaharidih, zahvaljujoč delovanju encimov glukozidaze.
[TOC]
Kaj je hidroliza?
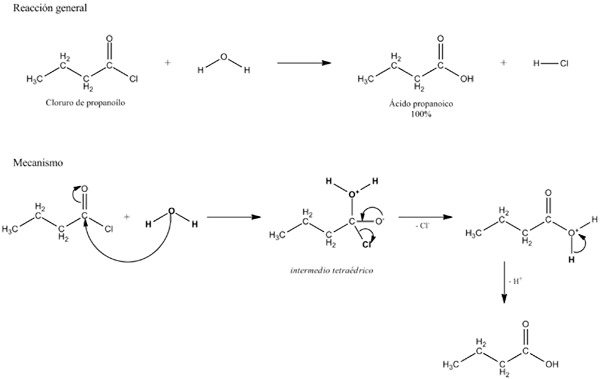
Zgornja slika pojasnjuje, iz česa je sestavljena hidroliza. Upoštevajte, da ne samo molekula ali substrat (če posredujejo encime) razbije svojo povezavo, ampak tudi voda, ki je "zlom" v H+ in oh-, Kjer h+ konča z a in oh- z b. A-B reagira z molekulo vode, ki izvira iz dveh izdelkov, A-H in B-OH.
Hidroliza je torej reakcija v nasprotju s kondenzacijo. V kondenzaciji sta dva izdelka, če rečem A-H in B-OH, vezana z sproščanjem majhne molekule: voda. Pri hidrolizi porabimo molekulo, medtem ko se v kondenzaciji sprošča ali proizvaja.
Lahko vam služi: karbonilna skupina: značilnosti, lastnosti, nomenklatura, reaktivnostČe se vrnete k primerku sladkorjev, predpostavimo, da A-B ustreza dimeru saharoze, kjer predstavlja glukozo, in B fruktozo. A-B, glukozidna povezava lahko hidrolizarizira, da izhajata oba monosaharida ločeno in v raztopini, enako pa se zgodi z oligo in polisaharidi, če v takšnih reakcijah posredujejo encime.
Upoštevajte, da ima v tej reakciji puščica A-B samo en naslov; to pomeni, da gre za nepopravljivo hidrolizo. Vendar so številne hidrolize v resnici reverzibilne reakcije, ki dosežejo ravnovesje.
Primeri reakcij hidrolize
- ATP
ATP je stabilen med pH vrednosti 6,8 in 7,4. Vendar je pri ekstremnih pH vrednostih spontano hidroliziran. Pri živih bitjih hidrolizo katalizirajo encimi, znani kot Atasas:
ATP +H2O => adp +pi
Ta reakcija je močno ekgonična, saj je entropija ADP večja kot pri ATP. Gibbs prosta nihanje energije (ΔGº) je - 30,5 kJ/mol. Energija, ki jo proizvaja hidroliza ATP, se uporablja v številnih reakcijah Endergona.
Povezane reakcije
V nekaterih primerih se za pretvorbo spojine v spojini uporablja hidroliza ATP (B).
A +ATP +H2Ali B +ADP +PI +H+
- Voda
Dve molekuli vode se lahko med seboj reagirajo v navidezni hidrolizi:
H2Ali + h2Ali h3Tudi+ + Oh-
Kot da bi ena od teh molekul vode zlomljena v h+ in oh-, Povezava H+ Na atom kisika druge molekule vode, ki povzroči hidrijev ion, h3Tudi+. Ta reakcija več kot hidroliza govori o samopropotolizi vode.
Vam lahko služi: aktivacijska energija- Beljakovine
Beljakovine so stabilne makromolekule in za doseganje popolne hidrolize v aminokislinah, ki jih sestavljajo, so potrebni ekstremni pogoji; na primer koncentracija klorovodikove kisline (6 m) in visoke temperature.
Vendar so živa bitja obdarjena z encimskim arzenalom, ki omogočajo hidrolizo beljakovin v aminokislinah v dvanajstniku. Encimi, ki sodelujejo pri prebavi beljakovin, skoraj popolnoma izloča trebušna slinavka.
Obstajajo encimi eksopeptidaze, ki razgradijo beljakovine, začenši na njihovih koncih: aminopeptidaza skozi amino konec in karboksipeptidaza skozi karboksilni konec. Encimi endopeptidaze izvajajo svoje delovanje v beljakovinski verigi, na primer: tripsin, pepsin, himotripsin itd.
- Amide in estri
Amidi, ko se segrejejo v alkalnem mediju, izvirajo iz karboksilne kisline in amina:
Rconh2 + H2O => rcoo- + Nh2
Abeati v vodnem mediju se hidrolizirajo v karboksilni kislini in alkoholu. Postopek katalizira baza ali kislina:
RCO-OR ' +H2O => rcooh +r'oh
To je znana reakcija saponifikacije.
- Kislinska baza
V vodi se več vrst hidrolizira, da zakisajo ali alkalizirajo vodno okolje.
Dodajanje osnovne soli
Natrijev acetat, osnovna sol, disociatira v vodi, ki daje ione+ (natrij) in cho3COO- (acetat). Njegova osnovna je, ker je acetat hidroliziran za ustvarjanje ionov OH-, Medtem ko natrij ostane nespremenjen:
Pogl3COO- + H2Ali pogl3COOH +OH-
Lahko vam služi: metil salicilatOh- Odgovoren je, da se pH poveča in postane osnovni.
Dodajanje kisle soli
Amonijev klorid (NH4Cl) tvori kloridni ion (Cl-) iz klorovodikove kisline (HCl), močne kisline in amonijevega kationa (NH4+) iz amonijevega hidroksida (NH4OH), šibka osnova. Cl- V vodi se ne loči, a amonijev kation se na naslednji način pretvori v vodo:
Nh4+ + H2Ali nh3 + H3Tudi+
Hidroliza amonijevega kationa proizvaja protone, ki povečujejo kislost vodnega medija, zato je sklenjeno, da NH4Cl je kisla sol.
Dodajanje nevtralne soli
Natrijev klorid (NACL) je solni produkt reakcije močne baze (NaOH) z močno kislino (HCl). Pri raztapljanju natrijevega klorida v vodi nastane natrijev kation (NA+) in anion (Cl-). Oba iona se ne ločita v vodi, zato ne dodajata h+ ali oh-, ohranjanje konstantne pH.
Zato se reče, da je natrijev klorid nevtralna sol.
Reference
- Mathews, c. K., Van Holde, k. In. In ahern, k. G. (2002). Biokemija. (Tretja izdaja). Uredi. Pearson-Addison Wesley.
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Čelada, Anne Marie, ph.D. (13. januar 2019). Hidroliza: definicija in primer. Okreval od: Thoughtco.com
- Theresa Phillips. (28. april 2019). Pojasnilo procesa hidrolize. Okreval od: uravnoteženosti.com
- Uredniki Enyclopeedia Britannica. (16. november 2016). Hidroliza. Encyclopædia Britannica. Okrevano od: Britannica.com
- Wikipedija. (2019). Hidroliza. Pridobljeno iz: v.Wikipedija.org

