Hidrazina struktura, lastnosti, sinteza, uporablja

- 2707
- 571
- Percy Feeney
The Hidrazin Je anorganska spojina, katere kemijska formula je n2H4. Sestavljen je iz člana družine dušikovih hidrorjev, najpreprostejši pa je najpreprostejši od vseh. Čeprav se njegova molekula zdi preprostost, ima več kemijskih in fizikalnih lastnosti, zaradi katerih je hidrazin zanimiva in energično obetavna snov.
Ohranite tesno podobnost z vodo, saj obe obstajata kot tekoče snovi v podobnih intervalih temperature. Iz hidrazina lahko dobimo organske derivate z nadomeščanjem njegovih vodikov s gaziranimi skupinami. Tudi iz njega sintetiziranih hidrazonov, hidrazidov in hidrazinskih soli.
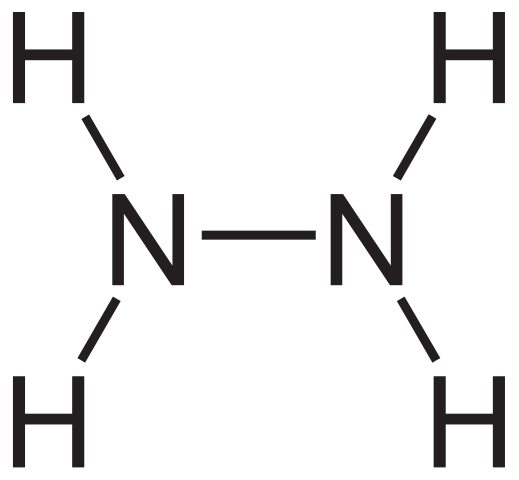 Hidrazinska strukturna formula. Vir: Neurotoger prek Wikipedije.
Hidrazinska strukturna formula. Vir: Neurotoger prek Wikipedije. Strukturno formulo hidrazina je mogoče videti zgoraj, ki jo lahko zapišemo kot h2Nnh2 ali h2N-NH2. Če natančno pogledate, se zdi, da dve molekuli NH3 Med seboj bi se povezali. Vendar pri nastanku N-N povezave ne samo molekule amoniaka, saj sodelujejo reagenti.
Hidrazin je spojina, ki ima več aplikacij, saj je odličen predhodnik za simfine spojin, tako organskih kot anorganskih. Prav tako je zahvaljujoč svoji zmanjševanju moči in njegovih izdelkov za razgradnjo usojeno odpraviti kisik in druge pline, pridobiti plemenite kovine; In še posebej za povečanje vesoljskih plovil in držav -Art letala.
[TOC]
Struktura hidracina
Molekula in povezava
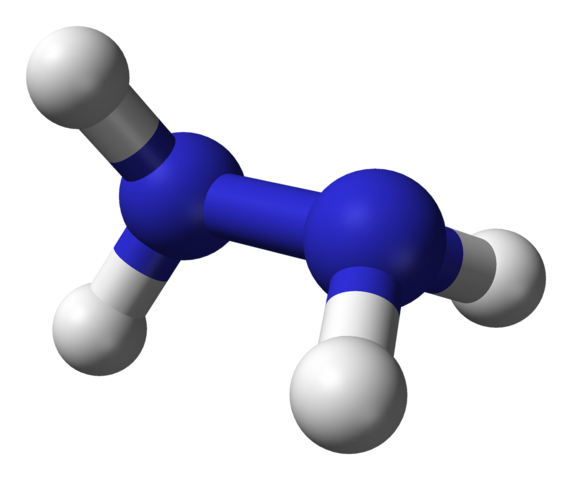 Molekularna struktura hidrazina. Vir: Ben Mills prek Wikipedije.
Molekularna struktura hidrazina. Vir: Ben Mills prek Wikipedije. Na zgornji sliki imamo molekulo hidrazina, ki jo predstavlja model sfer in palic. Upoštevajte, da prostorska orientacija vodikovih atomov, belih kroglic, je v nasprotju z vtisom, ki ga ponuja strukturna formula; to pomeni, da vodiči obeh -nh2 Niso poravnani ali zasenčeni, ampak imajo med seboj 95 ° vrteči se.
Pravzaprav je toliko, da se povezava N-N komajda vrti, saj ima energijsko oviro, ki jo je treba poteklo za zasenčiti štiri vodikove atome.
Za kaj je to? Načeloma, do močnih elektronskih odbojnosti, ki medsebojno doživljata dva para samotnih elektronov na dušikovih atomih. Ta 95 ° kot je tisti, ki daje hidrazinski molekuli največjo stabilnost.
Vam lahko služi: litijev bromid: struktura, lastnosti, uporabe, tveganjaGeometrije
Vsak atom dušika ima hibridizacijo SP3, Sprejetje trikotne geometrije piramide. Zato bi lahko s pari prostih elektronov molekula hidracina, kot sta dve piramidi, povezana z enim od njegovih točki.
Medmolekularne interakcije
Formula h2Nnh2 Lahko bi dal lažno idejo, da je hidrazin apolarna spojina za povezavo dve enaki skupini. Vendar molekularna struktura in njegova zasukana N-N vez kažeta, da molekula ni povsem simetrična, pri čemer omenjajo tudi, da njihovi prosti elektronski pari ne kažejo v nasprotnih smereh.
To pomeni, da hidrazin, ki je strukturno in elektronsko asimetričen, predstavlja dipolni trenutek. In zato njihove molekule medsebojno delujejo skozi dipol-dipol2Nnh2-Nh2Nh2, ki so odgovorni za hidrazin, ki ima zelo visoko vrelišče.
Lastnosti hidracina
 Hidrazin hidrat. Vir: lhchem/cc by-sa (https: // creativeCommons.Org/licence/by-sa/3.0
Hidrazin hidrat. Vir: lhchem/cc by-sa (https: // creativeCommons.Org/licence/by-sa/3.0 Fizični videz
Hidrazin je brezbarvna tekočina, podobna voda glede viskoznosti in gostote. Ko se opeče, oddaja bele hlape, poleg pridobivanja amoniaka in rib.
Molarna masa
32.0452 g/mol
Tališče
2 ° C.
Vrelišče
114 ° C. Upoštevajte, da hidrazin obstaja v tekočem stanju v temperaturnem intervalu 2-114 ° C, zelo podobno kot v vodi, 0-100 ° C.
Gostota
1.021 g/cm3
Gostota pare
1.1 v zračnem odnosu.
Parni tlak
Okoli 0.010 ATM pri 30.7 ° C
Topnost
Hidrazin je mešan z vodo, pa tudi z več primarnimi alkoholi. Hidrazin tvori hidrat z vodo, n2H4· H2Ali, za katero je značilno gostejšo kot čisti ali brezvodni hidrazin. Ta hidrat je najbolj tržen izdelek, saj je bolj stabilen in poceni.
Dipolarni trenutek
1.85 d. Je precej polarna snov, skoraj enako kot voda.
Lahko vam služi: jodijeva kislina (HIO3): struktura, lastnosti, tveganja in uporabeGoo
0.876 CP
Plamenišče
52 ° C
Temperatura samostojnosti
Se razlikuje glede na snovi ali površine, s katerimi pride v stik. Na primer, na železnih oksidih gori pri 23 ° C, na steklu ali drugih posodah pa se začne vnesti do 270 ° C.
Razgradnja
Ko gori v zraku, se razpade v dušikovih oksidih, nex. Glede njegove katalitične razgradnje, to je, da se pospešijo kovinski oksidi ali kovine, dobimo izdelke, kot so amoniak, dušik in vodik.
Reaktivnost
Hidrazin je dobro reducirajoče sredstvo, saj ob oksidiranju proizvaja vodo in dušik, obe spojini, ki ne trpita sekundarnih reakcij.
Po drugi strani je hidrazin nukleofil, saj uporablja svoje pare prostih elektronov, da se pridruži drugim organskim molekulam. Prav tako lahko trpi za zamenjavo3, Za proizvodnjo metiliranih derivatov: ch3Nhnh2 ali (pogl3)2Nnh2.
Reagira z močnimi kislinami, da tvori hidrazinio soli, n2H5X in iz Hidrazonio, n2H6X2. Slednji so najmanj pogosti. Hidrazinijev sulfat, [n2H5] HSO4, Pripravimo ga z reakcijo hidrazin hidrata z žveplovo kislino.
Basicy
Hidrazin je šibkejša podlaga kot amonijak:
N2H4(Ac) + h2Ali (l) ⇌ n2H5+(AC) + OH-(AC)
Kb = 1.3 · 10-6
To je zato, ker Hydrazinio konjugira kislino2H5+ ali h3N+-Nh2, ima svojo obremenitev destabilizirana z privlačnostim učinka skupine NH2; torej namesto da bi zagotovili elektronsko gostoto pozitivnemu dušiku, umik.
Hidrazin je sposoben trpeti drugo, veliko manj verjetno protonacijo, ki ustvarja še bolj nestabilno konjugirano kislino:
N2H5+(Ac) + h2Ali (l) ⇌ n2H6+(AC) + OH-(AC)
Kb = 8.4 · 10-16
Hidrazonij, n2H6+ ali h3N+-N+H3, Zaradi odbojnosti med pozitivnimi obremenitvami obeh dušikovih atomov je zelo nestabilen. Vendar lahko v družbi nekaterih anionov obstaja kot sol.
Strupenost
Anhidra hidrazin je izjemno strupen, kaustična in morda rakotvorna snov, da ne omenjam, da je zelo eksplozivna, zato je treba manipulirati le po strogih varnostnih protokolih.
Vam lahko služi: Faktor stisljivosti: Kako izračunati, primeri in vajeSinteza
Najbolj uporabljena metoda za sintezo hidrazina je postopek Raschig. To je sestavljeno iz naslednjih dveh reakcij:
Nh3(AC) + NAOCL (AC) → NH2Cl (AC) + NaOH (AC)
2NH3(AC) + NH2Cl (ac) → n2H4(AC) + NH4Cl (ac)
Na koncu nastane hidrat n2H4· H2Ali, ki je destilirana v prisotnosti KOH ali NaOH kot suhe trdne snovi:
N2H4· H2O → n2H4
Na ta način dobimo anhidra hidrazin in nastane povezava N-N.
Uporaba hidrazina
 Hidrazin je ena najbolj cenjenih snovi v vesoljskem razcvetu. Vir: pxhere.
Hidrazin je ena najbolj cenjenih snovi v vesoljskem razcvetu. Vir: pxhere. - Hidrazin je v prisotnosti kovinskih katalizatorjev eksotermično pokvarjen, da nastane dušik in vodik, kar zagotavlja dovolj energije za povečanje letal, raket in satelitov.
- Ta nagnjenost k razpadu in povzročanju plinov se natančno uporablja za napihovanje polimernih materialov, kot sta guma ali polietilen, pri čemer jih spremeni v ustrezne pene.
- Prav tako lahko s sproščanjem plinov vlečejo druge, ki se raztopijo v ceveh iz cevi, zato je zelo koristno odpraviti kisik iz kotlov, s čimer se izognemo, da korodirajo.
- Hidrazin je predhodni material za številne organske spojine s farmakološkimi funkcijami, antifungicidi, herbicidi, insekticidi, gnojili itd. To je zaradi tega sintetizirano veliko cikličnih derivatov dušika.
- Nazadnje se hidrazin in njegove hidrazinijeve soli uporabljamo za zmanjšanje mineralov plemenite kovin, saj so v metalurški industriji zelo pomembni.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Hidrazin. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2020). Hidrazin. Pubchem Comunund Povzetek za CID 9321. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Uredniki Enyclopeedia Britannica. (2020). Hidrazin. Britannica Encyclopeedia. Okrevano od: Britannica.com
- Iridium naslednji. (20. junij 2017). Hidrazin - strupen za ljudi, vendar ga imajo radi sateliti. Okreval od: iridium.com

