Hexano (C6H14) Fizikalne in kemijske lastnosti, struktura, uporabe, toksičnost
- 1142
- 268
- Miguel Gutmann DVM
On heksan To je ogljikovodik, za katerega je značilno, da je organska spojina, katere kondenzirana kemična formula je c6H14. Je brezbarvna, prozorna tekočina, ki je ni mogoče pomešati z vodo. Predstavlja pet izomerov, linearno pa je eden najpomembnejših parafinskih ogljikovodikov v industriji in raziskave in raziskave.
Heksan dobimo z frakcionirano destilacijo surove nafte. Seveda je prisoten tudi v citrusih in hlapnih frakcijah različnih rastlin ali sadja, kot so jabolko, guava, praženi lešniki, sladki krompir in žajbelj.
 N-heksanska molekula. Vir: Benjah-BMM27 [javna domena]
N-heksanska molekula. Vir: Benjah-BMM27 [javna domena] Gre. Heksan se uporablja kot topilo v procesu ekstrakcije rastlinskih olj, pa tudi lipidov in maščob, prisotnih v onesnaženih vodah in tleh.
Ljudje, ki so profesionalno izpostavljeni heksanu, lahko doživijo škodo na perifernem živčnem sistemu, ki se kaže z mravljinčenjem in nogami v nogah in rokah; Poleg splošne mišične šibkosti in v hudih primerih atrofija skeletnih mišic.
[TOC]
Fizikalne in kemijske lastnosti heksanov
Fizični videz
Brezbarvna, prozorna in zelo nestanovitna tekočina.
Molarna masa
86.178 g/mol
Vonj
Bencin podoben
Prag vonja
1,5 ppm
Gostota
0,6606 g/ml
Tališče
-96 do -94 ° C
Vrelišče
68,5 do 69,1 ° C
točka vžiga
-22 ° C (zaprta skodelica).
Topnost vode
9,5 mg/l (praktično nepomembno z vodo)
Topnost v topilih
Zelo topno v etanolu, topno v etil etru in kloroformu. Mešan z alkoholom, kloroformom in etrom.
Relativna gostota pare z zrakom
2.97 (zrak = 1)
Koeficient oktanola/vode
Dnevnik p = 3.764
Parni tlak
17,60 kPa pri 20 ° C
Valovna dolžina največje optične gostote
200 nm
Lahko vam služi: niobio (nb): struktura, lastnosti, uporabe, pridobivanjeLomni količnik
1.375
Goo
0,3 MPa · s
Kalorična zmogljivost
265,2 j · k-1· Mol-1
Toplota zgorevanja
4.163,2 kJ · mol-1
Toplota za uparjanje
31,56 kJ · mol-1
Površinska napetost
17,89 mn/m a 25 ° C
Ionizacijski potencial
10,18 ev
Stabilnost
Stabilno. Nezdružljivo z oksidacijskimi sredstvi, klorom, fluoridom, magnezijevim perkloratom. Tvori eksplozivno mešanico z zrakom.
Reaktivnost
Heksan lahko močno reagira z oksidacijskimi materiali, ki lahko vključujejo tekoči klor, koncentrirani kisik, natrijev hipoklorit in kalcijev hipoklorit. Prav tako je nezdružljiv z diitrogenim tetroksidom. Hexane lahko napade nekatere oblike plastike, gume in premazov.
Heksanska struktura
Medmolekularne interakcije
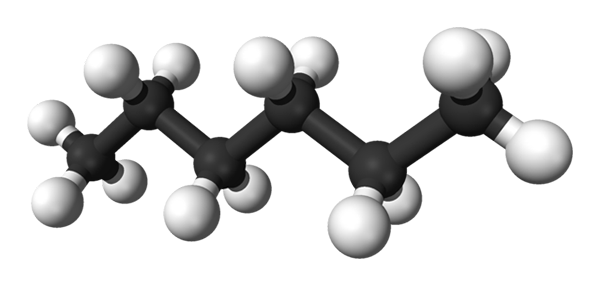
Prva slika prikazuje molekulo n-Heksan, ki ga predstavlja model sfer in palic. Črne kroglice ustrezajo ogljikovim atomom, ki sestavljajo cikcak ogljikovo okostje, bele krogle pa vodikove atome. On n-Hexano je torej ogljikovodikovo, linearno in zelo dinamično.
Ker so vse njegove povezave C-H nizka polarnost, molekuli primanjkuje dipolnega trenutka. Pri tem njene medmolekularne interakcije niso dipole-dipol.
Vsaka molekula n-Hexano "prilega" enega nad drugo pri zelo nizkih temperaturah, kot bi se domnevali v svoji kristalni strukturi. Po drugi strani se v tekočini njihova okostnjak upogiba in zasukajo svoje C-H vezi, ki izvirajo iz omenjene tekočine in zavre pri 68,7 ° C.
Izomeri
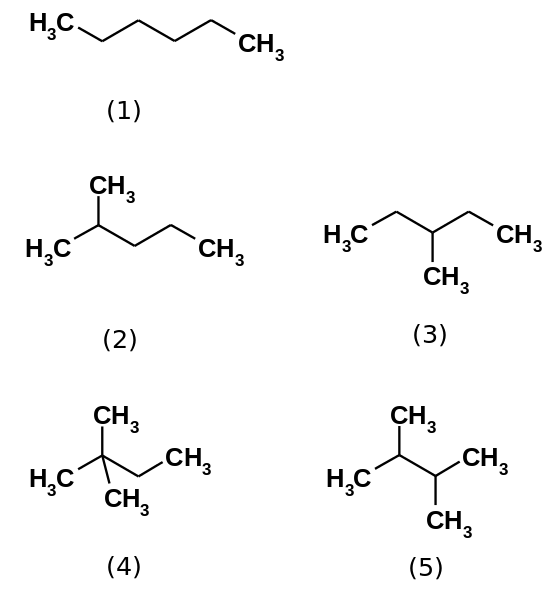 Pet heksanskih izomerov. Vir: Steffen 962 [javna domena]
Pet heksanskih izomerov. Vir: Steffen 962 [javna domena] Heksanski ogljikovodik dejansko sestavlja pet izomerov, ki so n-Heksan najmanj razvejan, (1). Ostali štirje izomeri so v naraščajočem vrstnem redu:
2-metilpropan (2)
3-metilpropan (3)
2,2-dimetilbutan (4)
2,3-dimetilbutan (5)
Upoštevajte, da se strukture bolj razvejajo od (1) do (5). Ker so bolj razvejane, disperzivne sile, se zmanjšujejo, ker ni več linearnih delov, ki bi se učinkovito zdravili. To vodi do zmanjšanja in spreminjanja vrelišč izomerov; Čeprav opažamo določena sprejemljiva neskladja.
Vam lahko služi: kaj je erristeneo?Oba 2-metilpropana. Nato mu sledi 2,3-dimetilbutan (PEB = 58 ° C), da končno postavite 2,2-dimetilbutan kot najbolj hlapno tekočino (PEB = 49,7 ° C).
Prijave
Heksan se meša s podobnimi kemikalijami za proizvodnjo topil. Med imeni, ki jih dobijo ta topila, so komercialni heksan, mešani heksani itd. Uporabljajo se kot čistilna sredstva v tekstilni industriji, pohištvu in votlem tiskanju.
Hexane je sestavina lepila, ki se uporablja pri hidroizolaciji streh, v obutvi in usnju. Uporablja se tudi za vezavo knjig, za oblikovanje tablet in tablet, zapiranje, izdelavo pnevmatik in baseball kroglic.
Heksan se uporablja pri določanju indeksa refrakcije mineralov in polnjenju tekočine za termometre namesto živega srebra; Na splošno z rdečim ali modrim barvilom. Uporablja se tudi pri ekstrakciji maščob in vodnega olja za analizo njegovih onesnaževal.
Hexano se uporablja kot topilo pri ekstrakciji rastlinskega semenskega olja, kot so soja, kanola ali bit. Poleg tega se uporablja za razporeditev kosov različnih poreklov. Uporablja se pri denaturaciji alkohola, v metodi analize HPLC in spektrofotometriji.
Strupenost
Vdihavanje in stik
Akutna toksičnost heksana je razmeroma nizka, čeprav je blag anestetik. Akutna izpostavljenost visokim heksanskim koncentracijam lahko nastane z vdihavanjem, blago depresijo centralnega živčnega sistema (CNS), ki se kažejo omotica, vrtoglavica, blag slabost in glavobol.
Vam lahko služi: endotermična reakcijaLahko povzroči tudi dermatitis in draženje oči in grla. Kronično vdihavanje heksana, povezano z delovno aktivnostjo, lahko povzroči poškodbe perifernega živčnega sistema (senmomotorna polinevropatija).
Začetni simptomi so mravljinčenje in krči in roke, ki jim sledi mišična šibkost. V hudih primerih je lahko atrofija skeletnih mišic, skupaj z izgubo koordinacije in težav z vidom.
Toksičnost heksana je povezana z generiranjem heksana-2,5-diona metabolita. To reagira z aminokislinskim lizinom beljakovinske bočne verige, ki povzroči izgubo delovanja beljakovin.
Varen odmerek
Agencija za okolje za zaščito (EPA) je izračunala referenčno koncentracijo (RFC) za 0,2 mg/m heksana3, in referenčni odmerek (RFD) 0,06 mg/kg teže/dan.
V šestdesetih in sedemdesetih letih prejšnjega stoletja je prisotnost živčnih sprememb. Vzrok je bil, da so vdihnili ozračje heksana od 500 - 2.500 ppm, 8-14 ur na dan.
Delavci so predstavili znane simptome kroničnega vdihavanja heksana in odkrili zdravnike, da so se poškodovali živci, ki so nadzirali mišice rok in nog.
Reference
- Danielle Reid. (2019). Heksan: struktura, formula in lastnosti. Študij. Okrevano od: študij.com
- Nacionalni center za informacije o biotehnologiji. (2019). Heksan. Baza podatkov Pubchem. Cid = 8058. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Wikipedija. (2019). Heksan. Pridobljeno iz: v.Wikipedija.org
- Svet molekul. (s.F.). Molekula heksana. Okrevano od: WorldOfMolecules.com
- Kemijska knjiga. (2017). Heksan. Obnovi se od: Kemicalbook.com
- Skupnost Avstralije. (s.F.). N-heksan: Viri izdaj. Okreval od: NPI.Gov.Au
- EPA. (2000). Heksan. [PDF]. Okrevano od: EPA.Gov
- Agencija za strupene snovi in register bolezni. (1999). Izjava o zdravju pub za N-Hexan. Pridobljeno iz: atsdr.CDC.Gov
- « 5 poskusov kemičnih reakcij (preprosti in varni)
- Značilnosti Toronjila, habitat, lastnosti, gojenje, nega »

