Zgodovina Helio, lastnosti, struktura, tveganja, uporabe

- 5103
- 1171
- Ignacio Barrows
On helija Je kemični element, katerega simbol je. To je prvi plemenit plin v periodični tabeli in se običajno nahaja na koncu istega. V normalnih pogojih je inertni plin, saj nobena od njenih nekaj spojin ni stabilna; Prav tako se zelo hitro razširi in je snov z najmanjšo vrelišče od vseh.
Na priljubljeni ravni je dobro znan plin, saj je v neštetih dogodkih ali otroških zabavah običajna. Vendar se tisto, kar se resnično in za vedno izgubi proti kotičkom sončnega sistema, in naprej, to so atomi helijev, ki se sprostijo, ko se globus pokvari.
 Baloni, napihnjeni s helijem, najbližje, ki so lahko v tem elementu v vsakdanjem situacijah. Vir: Pixabay.
Baloni, napihnjeni s helijem, najbližje, ki so lahko v tem elementu v vsakdanjem situacijah. Vir: Pixabay. Pravzaprav obstajajo tisti, ki in z velikim razlogom verjamejo, da helijev baloni predstavljajo neprimerno prakso za ta plin. Na srečo ima pomembnejše in zanimive uporabe, zahvaljujoč fizikalnim in kemičnim lastnostim, ki jo ločujejo od drugih kemičnih elementov.
Na primer, tekoči helij je tako hladen, da lahko zamrzne karkoli, kot kovinska zlitina, zaradi česar je superprevodniški material. Prav tako je tekočina, ki manifestira presežek, ki lahko pleza po stenah steklene posode.
Ime mu je zato, ker je bil prvič identificiran na soncu in ne na zemlji. To je drugi najpogostejši element v celotnem vesolju in čeprav je njegova koncentracija smešna v zemeljski skorji, ga je mogoče dobiti iz rezerv zemeljskega plina in radioaktivnih mineralov urana in torija.
Tu helij kaže še eno radovedno dejstvo: to je plin, ki veliko več v podzemlju veliko več kot v atmosferi, kjer na koncu uhaja iz zemlje in njenega gravitacijskega polja.
[TOC]
Zgodovina
Helij ni bil odkrit na zemlji, ampak na soncu. Pravzaprav njegovo ime izvira iz grške besede "helios", kar pomeni sonce. Samo obstoj elementa je bil v nasprotju s periodično tabelo Dmitrija Mendeléjeva, ker za nov plin ni bilo mesta; torej do takrat ni bilo ničesar o plemenitih plinih.
Ime 'Helio', napisano kot 'helij' v angleščini, se je končalo s pripono -ium, ki se nanaša nanj kot kovino; Prav zato, ker obstoja drugega plina, razen kisika, vodika, fluora, klora in dušika.
To ime je označil angleški astronom Norman Lockyer, ki je iz Anglije študiral, kaj je opazil francoski astronom.
Do takrat je bila rumena spektralna črta neznanega elementa. Lockyer je dejal, da je to posledica prisotnosti novega kemičnega elementa, ki ga najdemo na soncu.
Leta 1895, skoraj dvajset let pozneje, je škotski kemik Sir William Ramsay pri preučevanju radioaktivnega minerala prepoznal isti spekter iz preostalega plina: Cleveíta. Tudi tukaj je bil Helio.
Fizikalne in kemijske lastnosti
Videz
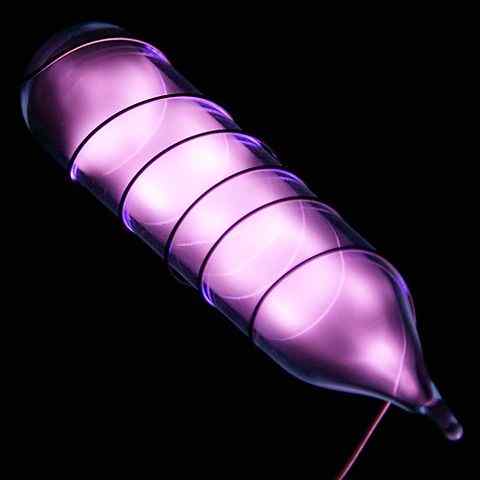 Ampoule z vzorcem helija, ki sije po električnem udarcu. Vir: Hi-ločke slike kemijskih elementov [CC do 3.0 (https: // creativeCommons.Org/licence/by/3.0)]
Ampoule z vzorcem helija, ki sije po električnem udarcu. Vir: Hi-ločke slike kemijskih elementov [CC do 3.0 (https: // creativeCommons.Org/licence/by/3.0)] Helij je brezbarven plin brez vonja, ki nima okusa in je tudi inerten. Ko pa se nanese električni šok in odvisno od razlike v napetosti, začne sijati kot sivkasto-moralna megla (zgornja slika), nato zasije z oranžnim sijajem. Zato so helijeve luči oranžne.
Atomsko število (z)
2
Molarna masa
4.002 g/mol
Tališče
-272,2 ° C
Vrelišče
-268,92 ° C
Gostota
-0,1786 g/L v normalnih pogojih, torej v plinski fazi.
-0,145 g/ml, na tališču, tekoči helij.
-0,125 g/ml, ravno takrat, ko helij začne vreti.
-0,187 g/ml, pri 0 K in 25 atm, torej trden helij do teh specifičnih tlakov in temperaturnih pogojev.
Trojna točka
2.177 K in 5,043 kPa (0,04935 atm)
Kritična točka
5,1953 K in 0,22746 MPa (2.2448 atm)
Fuzijska toplota
0,0138 kJ/mol
Toplota za uparjanje
0,0829 kJ/mol
Molarna toplotna sposobnost
20,78 j/(mol · k)
Parni tlak
0,9869 atm pri 4,21 K. Ta vrednost služi za predstavo o tem, kako flota.
Ionizacijske energije
-Najprej: 2372,3 kJ/mol (on+ plinasto)
-Drugi: 5250,5 kJ/mol (on2+ plinasto)
Ionizacijske energije za helij so še posebej visoke, ker mora atom plina izgubiti elektron, ki ima močno učinkovito jedrsko obremenitev. Prav tako je mogoče razumeti, če se upošteva majhna velikost atoma in kako sta "blizu" dva elektrona glede na jedro (z dvema protonoma in dvema nevtronoma).
Topnost
V vodi se 0,97 ml raztopi na 100 ml vode pri 0 ° C, kar pomeni, da je malo topno.
Vam lahko služi: amonijev oksalatReaktivnost
Helij je drugi najmanj reaktivni kemični element v naravi. V normalnih pogojih je uspešno pritrditi, da gre za inertni plin; Nikoli (za kar se zdi) ne moremo manipulirati s helijevo spojino v sobi ali laboratoriju, ne da bi nanjo delovali ogromni pritiski; ali morda, dramatično visoke ali nizke temperature.
Primer, ki ga vidimo v sestavi2On, ki je stabilen le pod tlakom 300 GPa, reproduciran v celici Diamond Yunque.
Medtem ko kemične vezi v NA2Imeti "neznance", da imajo svoje elektrone dobro nameščene v kristalih, še zdaleč niso preproste interakcije van der sten, zato ne sestavljajo zgolj atomov helija, ujeti z molekularnimi agregati. Tu je dilema, med katero so resnične helijeve spojine.
Na primer, dušikove molekule do visokih pritiskov lahko zaprejo atom helija, da povzročijo nekakšen črpanje2)enajst.
Obstajajo tudi endo -podstavek kompleksov fulerenskih kationov, c60+n in c70+n, v katerih vdolbinici lahko nastanejo atomi helijev; in molekularna kation heh+ (He-H+), ki jih najdemo v zelo oddaljenih meglici.
Številka oksidacije
Kdo iz radovednosti poskuša izračunati oksidacijsko številko za helij v katerem koli od njegovih spojin, bo ugotovil, da je to enako 0. V NA2Na primer bi lahko mislili, da njegova formula ustreza hipotetičnim NA ionom2+On2-; Toda takšno bi bilo domnevati, da ima čisti ionski značaj, ko v resnici njegove povezave še zdaleč niso.
Poleg tega Helium ne osvoji elektronov, ker jih ne more sprejeti v 2S orbitalni, nedosegljivi energiji; In tudi ni mogoče, da jih izgubite zaradi zmanjšane velikosti njenega atoma in velike učinkovite jedrske obremenitve njenega jedra. Zato Helium vedno sodeluje (teoretično) kot atom0 V izpeljanih spojinah.
Elektronska struktura in konfiguracija
Helij, tako kot vsi plini, ki jih opazimo v makroecali. Ko pa se temperatura spusti in se začne ohladiti pod -269 ° C, se plin kondenzira v brezbarvni tekočini; Helij I, prvi od obeh tekočih faz za ta element.
Razlog, zakaj se helij kondenzira pri tako nizki temperaturi, je posledica nekaj disperzijskih sil, ki ohranjajo atome skupaj; Ne glede na upoštevanje faze. To je mogoče razložiti iz njegove elektronske konfiguracije:
1s2
V katerem dva elektrona zasedata 1S atomsko orbitalo. Atom helija lahko vizualiziramo kot skoraj popolno kroglo, katere homogeno elektronsko periferijo ni zelo nagnjeno k polarizaciji z učinkovito jedrsko obremenitvijo obeh protonov v jedru.
Tako so spontani in inducirani dipolni trenutki redki in zelo šibki; Tako se mora temperatura približati absolutni ničli, tako da so se atomi približali zadostni počasnosti in da njihove disperzivne sile določijo tekočino; Ali še bolje, helijev kozarec.
Dimerji
V plinasti fazi je prostor, ki ločuje atome, tak, da je mogoče domnevati, da je eden od drugih vedno ločen. Toliko, da v pretisni omoti, malo volumna, helij izgleda brezbarvno, dokler ni podvržen električnemu šoku, ki ionizira svoje atome v sivkasti in malo svetli meglici.
Vendar pa v tekoči fazi atomi, tudi s svojimi šibkimi interakcijami, dlje časa ne morejo več "ignorirati". Zdaj jim disperzijska sila dovoljuje2. Zato lahko o heliju I razmišljate kot o ogromnih grozdih2 v ravnovesju z atomi pare faze.
Zato je Helium I tako težko razlikovati od svojih hlapov. Če se ta tekočina razlije zunaj njene hermetične posode, pobegne kot belci.
Helio II
Ko temperatura še bolj pade in se dotakne 2.178 K (-270,972 ° C), se pojavi fazni prehod: helij I se pretvori v helij II.
Od tega trenutka fascinantna helijeva tekočina postane odvečna ali kvantna tekočina; to pomeni, da se njegove makroskopske lastnosti kažejo, kot da so dimerji2 Bili so posamezni atomi (in morda so). Manjka mu popolna viskoznost, ker ni površine, ki bi lahko ustavila atom med njegovim drsenjem ali "plezanjem".
Zato se lahko Helio II dvigne skozi stene steklene posode, ki premaga silo gravitacije; Ne glede na to, kako visoki so, dokler površina ostane pri isti temperaturi in se zato ne obdrži.
Lahko vam služi: hipofiza (H3PO2): lastnosti, uporabe in reagentiZaradi tega tekočega helija ni mogoče shraniti v steklene posode, saj bi pobegnil pred najmanjšo razpoko ali vrzel; Zelo podobno, kako bi se to zgodilo s plinom. Namesto tega se nerjaveče jeklo uporablja za oblikovanje teh zabojnikov (rezervoarji Dewars).
Kristali
Čeprav se je temperatura spustila do 0 K (absolutna nič), disperzijska sila med atomi ne bi bila dovolj močna, da bi jih naročila v kristalni strukturi. Za utrditev se mora tlak povečati na približno 25 atm; In potem se pojavijo kompaktni šesterokotni kristali (HCP).
Geofizične študije kažejo, da ta struktura HCP ostaja nespremenjena, da se pritisk poveča (do vrstnega reda Pascal Giga, GPA). Vendar pa je v njegovem diagramu tlačne temperature ozko območje, kjer ti kristali HCP trpijo prehod na kubično fazo, osredotočeno na telo (BCC).
Kje je in dobimo
Kozmos in skale
 Helij predstavlja drugi najpogostejši element vesolja in 24% njegove mase. Vir: pxhere.
Helij predstavlja drugi najpogostejši element vesolja in 24% njegove mase. Vir: pxhere. Helij je drugi najpogostejši element v celotnem vesolju, ki ga je presegel le vodik. Zvezde nenehno proizvajajo neizmerne količine helijevih atomov z združitvijo dveh vodikovih jeder med postopkom nukleosinteze.
Prav tako je vsak radioaktivni proces, ki oddaja α delce, vir proizvodnje helijevih atomov, če sodelujejo z elektroni okolja; Na primer, s telesom skalnega telesa v rezervoarjih radioaktivnih mineralov urana in torija. Ta dva elementa trpita radioaktivno propadanje, začenši z uranom:
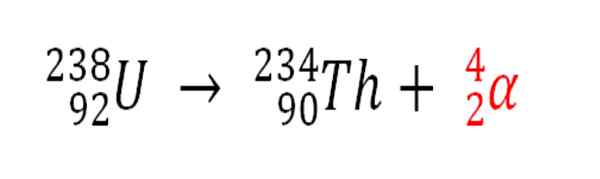 Radioaktivno razpadanje v uraniju pri tvorbi delcev Alfas, ki se pozneje v podzemnih nahajališčih spremenijo v atom helija. Vir: Gabriel Bolívar.
Radioaktivno razpadanje v uraniju pri tvorbi delcev Alfas, ki se pozneje v podzemnih nahajališčih spremenijo v atom helija. Vir: Gabriel Bolívar. Zato bodo v kamninah, kjer so koncentrirani ti radioaktivni minerali, ujeti atomi helija, ki se bodo sprostili, ko se bodo prebavili v kislih medijih.
Med nekaterimi minerali so Cleveíta, Carnotita in Uraninite, vsi sestavljeni iz uranovih oksidov (UO2 ali u3Tudi8) in nečistoče do torija, težkih kovin in redkih zemljišč. Helij, ki se namaka skozi podzemne kanale, se lahko na koncu kopiči v rezervoarjih zemeljskega plina, mineralnih vzmeti ali v meteornih likalnikih.
Ocenjujejo, da se letno proizvaja masa helija, enakovredna 3000 ton, iz radioaktivnega razpada urana in torija.
Zrak in morja
Helij ni zelo topen v vodi, tako da prej kot slej na koncu vzponi od globin (kjer najdejo njen izvor), da prečka plasti atmosfere in končno dosežemo stranski prostor. Njeni atomi so tako majhni in lahki, da jih gravitacijsko polje ne more obdržati v atmosferi.
Zaradi zgoraj navedenega je koncentracija helija tako v zraku (5,2 ppm) kot v morju (4 ppt) zelo nizka.
Če bi želeli izvleči iz katerega koli od teh dveh medijev, bi bila "najboljša" možnost zrak, ki bi ga najprej morala predložiti utekočinjenosti, da bi kondenzirala vse svoje sestavne pline, medtem ko helij ostane v plinastem stanju.
Vendar ni praktično pridobiti helija iz zraka, ampak iz kamnin, obogatenih z radioaktivnimi minerali; ali še bolje, rezerv zemeljskega plina, kjer lahko helij predstavlja do 7% celotne mase.
Utekočinjanje zemeljskega plina in destilacija
Namesto da bi podvrgli zraku, je lažje in donosnejše. Tako je odličnost surovine (komercialna) za pridobitev helija zemeljski plin, ki ga je mogoče predložiti tudi v delno destilacijo.
Končni produkt destilacije je končan s čiščenjem z aktiviranim ogljikom, ki gre skozi velik helij čistosti. In končno se helij loči od neona s kriogenim postopkom, kjer se uporablja tekoči helij.
Izotopi
Helij je v naravi predstavljen pretežno kot izotop 4On, čigar golo jedro je znani delček α. Ta atom 4Imam dva nevtrona in dva protona. V manjši številčnosti je izotop 3On, ki ima samo en nevtron. Prva je težja (ima večjo atomsko maso) kot druga.
Tako izotopski par 3On in 4Imajo tiste, ki definirajo očarane lastnosti in kaj razumemo o heliju kot kemični element. Od 3Lažji je, domneva se, da imajo njihovi atomi več kinetične energije in da zato potrebujejo še nižjo temperaturo za kohezivno v odveč za kohezivno.
On 3Tukaj na Zemlji sem razmišljal o zelo redki vrsti; Vendar pa je na lunanskih tleh bolj obilen (približno 2000 -krat). Zato je bila luna podvržena projektom in zgodbam kot možen vir 3On, ki bi ga lahko uporabili kot jedrsko gorivo za vesoljsko plovilo prihodnosti.
Vam lahko služi: čiste snoviMed drugimi helij lahko omenjamo izotope, s svojimi polčasnimi časi: 5On (t1/2= 7,6 · 10−22 s), 6On (t1/2= 0,8 s) in 8On (t1/2= 0,119 s).
Tveganja
Helij je inertni plin in zato ne sodeluje v nobeni reakciji, ki se pojavi v naših telesih.
Njegovi atomi praktično vstopajo in izdihnejo brez njihovih interakcij z biomolekulami, ki povzročajo poznejši učinek; razen v zvoku, ki se oddaja iz vokalnih vrvic, ki postanejo bolj akutni in imajo bolj frekvenco.
Ljudje, ki vdihnejo Helio iz balona (zmerno), govorijo z akutnim glasom, podobno kot veverice (ali raca).
Težava je v dejstvu, da če omenjena oseba vdiha neprimerno količino helija, tveganje za zadušitev teče, saj se njihovi atomi premaknejo na molekule kisika; In zato ne bo mogel dihati, dokler ne izdiha vsega helija, kar posledično zaradi pritiska lahko raztrga pljučno tkivo ali povzroči barotraume.
Primeri ljudi, ki so umrli zaradi Inhale Helio, so poročali o novo pojasnjenih.
Po drugi strani, čeprav ne predstavlja požarnega tveganja, če je pomanjkanje reaktivnosti na kisik (ali drugo snov), če je shranjen pod visokimi pritiski in pobegi, je lahko njegov pobeg fizično nevaren.
Prijave
Heliove fizikalne in kemijske lastnosti ne samo da so poseben plin, ampak tudi zelo uporabna snov za aplikacije, ki zaslužijo temperature v izjemno nizki. V tem razdelku bodo obravnavane nekatere od teh aplikacij ali uporabe.
Sistemi tlaka in čiščenja
V nekaterih sistemih je treba povečati tlak (tlak), za to pa ga je treba vbrizgati ali oskrbo, ki ne vpliva na nobeno od njegovih komponent; Na primer z reagenti ali površinami, občutljivimi na nezaželene reakcije.
Tako se lahko tlak poveča z količino helija, katerih kemična inercija je idealna za ta namen. Inertno vzdušje, ki olajša, presega nekatere primere dušika.
Za obratni postopek, to je, da se čiščenje uporablja tudi zaradi svoje sposobnosti vlečenja vseh kisika, vodnih hlapov ali katerega koli drugega plina, katerih prisotnost želi odpraviti. Na ta način se sistemski tlak zmanjša, ko se helij izprazni.
Odkrivanje puščanja
Helij lahko filtriramo skozi najmanjšo razpoko, zato služi tudi za odkrivanje puščanja v cevi, posodah z visoko vakuum ali kriogenimi rezervoarji.
Včasih je mogoče zaznati vizualno ali z dotikom; Vendar je večinoma detektor tisto, kar "vrže" signal, kje in koliko helija se izogne sistemu, ki ga pregleduje.
Vleči plin
Atomi helija, kot je omenjeno za čistilne sisteme, jih lahko vlečejo, odvisno od vašega pritiska, težjih molekul. Na primer, to načelo se vsakodnevno uporablja v analizi plinske kromatografije, saj lahko vzorec potegne atomiziran vzdolž stolpca, kjer deluje s stacionarno fazo.
Baloni in zračne ladje
 Helij se uporablja za napihovanje zračnih ladij in je veliko varnejši od vodika, ker ni vnetljiv plin. Vir: Pixabay.
Helij se uporablja za napihovanje zračnih ladij in je veliko varnejši od vodika, ker ni vnetljiv plin. Vir: Pixabay. Zaradi nizke gostote v primerjavi z zrakom in spet zaradi pomanjkanja reaktivnosti s kisikom se uporablja za napihovanje balonov na otroških zabavah (pomešan s kisikom, tako da se nihče ne zaduši za dihanje) in zračne ladje (vrhunska slika) , ne da bi lahko predstavljali tveganje za požar.
Potapljanje
 Helij je ena glavnih sestavnih delov rezervoarjev za kisik, s katerimi potapljači dihajo. Vir: pxhere.
Helij je ena glavnih sestavnih delov rezervoarjev za kisik, s katerimi potapljači dihajo. Vir: pxhere. Ko se potapljači spustijo v večje globine, težko dihajo zaradi velikega pritiska, ki ga izvaja voda. Zato je Helio dodan v svoje rezervoarje za kisik, da se zmanjša gostota plina, ki jo potapljači dihajo in izdihnejo, zato ga je mogoče izdihniti z manj dela.
Varjenje obloka
V procesu varjenja električni lok prinaša dovolj toplote, tako da se pridružita obe kovini. Če se izvede pod atmosfero helija, žarilna kovina ne bo reagirala s kisikom zraka, da bi postala njegov oksid; Zato Helium preprečuje, da bi se to zgodilo.
Superprevodniki
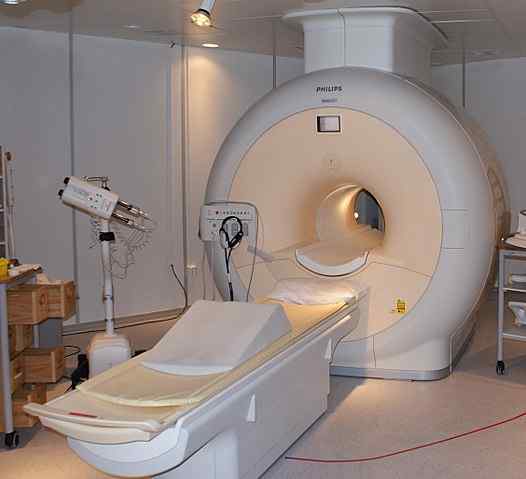 Tekoči helij se uporablja za hlajenje magnetov, ki se uporabljajo pri skenerjih jedrske magnetne resonance. Vir: Jan Ainali [CC do 3.0 (https: // creativeCommons.Org/licence/by/3.0)]
Tekoči helij se uporablja za hlajenje magnetov, ki se uporabljajo pri skenerjih jedrske magnetne resonance. Vir: Jan Ainali [CC do 3.0 (https: // creativeCommons.Org/licence/by/3.0)] Tekoči helij je tako hladen, da lahko zamrzne kovine, da jih spremeni v superprevodnike. Zahvaljujoč temu so bili izdelani zelo močni magneti, ki so bili v slik slik ali spektrometrov jedrske magnetne resonance uporabljeni v hladilniku s tekočim helijem.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Andy Estince. (17. april 2019). Helijev hidrid Ion, ki je bil prvič odkrit v vesolju: dokazi za nedostopno kemijo iz prvih minut vesolja. Okrevano od: ChemistryWorld.com
- Peter Wothers. (19. avgust 2009). Helija. Kemija v svojem elementu. Okrevano od: ChemistryWorld.com
- Wikipedija. (2019). Helija. Pridobljeno iz: v.Wikipedija.org
- Mao, h. K., Wu in., Jephcoat, a. Str., Hemley, r. J., Bell, str. M., & Bassett, w. Do. (1988). Kristalna struktura in gostota helija do 232 kbar. Pridobljeno iz: Članki.Adsabs.Harvard.Edu
- Nacionalni center za informacije o biotehnologiji. (2019). Helija. Baza podatkov Pubchem. Cid = 23987. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- MARY-ANN MUFFOLETTO. (6. februar 2017). Zgoraj, gor in stran: kemiki pravijo "da", helij lahko tvori spojine. Državna univerza Utah. Okrevano od: Phys.org
- Steve Gagnon. (s.F.). Izotopi helija elementov. Jefferson Lab. Okrevano od: izobraževanje.Jlab.org
- ADVAMEG, INC. (2019). Helija. Okrevano od: Kemiji.com

