Hafnium

- 3343
- 443
- Lee Farrell
 Kovinski hafnio vzorec. Vir: Hi-Res Slike kemičnih elementov [cc by (https: // creativeCommons.Org/licence/by/3.0)]
Kovinski hafnio vzorec. Vir: Hi-Res Slike kemičnih elementov [cc by (https: // creativeCommons.Org/licence/by/3.0)] Kaj je hafnio?
On Hafnium To je prehodna kovina, katere kemikalija je HF in ima atomsko število 72. Je tretji element skupine 4 periodične tabele, ki je kongene v titanu in cirku. S slednjim deli številne kemijske lastnosti, ki se nahajajo v mineralih Zemljine skorje.
Iskanje hafnio išče tam, kjer je cirkonij, ker je stranski produkt njegovega ekstrakcije. Ime te kovine izvira iz latinske besede "hafnia", katere pomen je ime Kopenhagen, mesto, kjer so ga odkrili v cirkonskih mineralih, in polemika se je končala glede na njegovo resnično kemijsko naravo.
Ta kovina odpira, da je zadnji od najbolj stabilnih elementov, odkritih tukaj na zemlji; to pomeni, da so druga odkritja predstavljala vrsto ultrapesadosov, radioaktivnih in/ali umetnih izotopov.
Hafnio spojine so analogne titanu in cirkoniju, pretežno številke oksidacije +4, kot je HFCL4, Hfo2, Hfi4 in hfbr4. Nekateri vodijo seznam najbolj ustvarjenih ognjevzdržnih materialov, pa tudi zlitine velike toplotne odpornosti in delujejo tudi kot odlični absorbenti nevtronov.
Zaradi tega ima Hafnio veliko sodelovanja v jedrski kemiji, zlasti pri reaktorjih za tlačno vodo.
Odkritje
Prehodna kovina ali redke zemeljske
Odkritje hafnio je bilo obkroženo s polemikami, čeprav je bil njen obstoj že napovedan od leta 1869, zahvaljujoč periodični tabeli Mendeleeva.
Težava je bila v tem, da je bila nameščena pod cirkonijem, vendar je sovpadala v istem obdobju elementov redkih Zemlje: lantanoides. Kemiki takrat niso vedeli, ali gre za prehodno kovino ali kovino iz redkih Zemlje.
 99,9% Hafnium Bar. Vir- Alchemist-HP (www.PSE-Mendelejew.od), cc by-sa 2.0, prek Wikimedia Commons
99,9% Hafnium Bar. Vir- Alchemist-HP (www.PSE-Mendelejew.od), cc by-sa 2.0, prek Wikimedia Commons Francoski kemik Georges Urbain, odkrivalec Luthacio, sosednje kovine Hafnio. Toda tri leta pozneje je bilo ugotovljeno, da so bili njegovi rezultati napačni in da je le izolirala mešanico lantanoides.
Šele ko so elemente ukazali njihova atomska številka, zahvaljujoč delu Henryja Moseleyja leta 1914, ki je bila soseska med Luthate in Element 72 dokaz enaka skupina kot Titanium in Okrožitveni kovini.
Vam lahko služi: flokulacija: reakcija, vrste, aplikacije, primeriOdkrivanje v Kopenhagnu
Leta 1921, po študijah atomske strukture Niels Bohr in njegovi napovedi rentgenskega spektra emisije X -Rara za element 72, smo to kovino ustavili v mineralih redkih Zemlje; In namesto tega se je njegovo iskanje na cirkonski minerali osredotočilo, saj sta morala oba elementa deliti več kemijskih lastnosti.
Danski kemik Dirk Coster in madžarski kemik Georg von Hevesy leta 1923 sta končno prepoznala predvideni spekter Niels Bohr v vzorcih cirkonov iz Norveške in Grenlandije. Ko so odkrili v Kopenhagnu, so poimenovali Element 72 po latinskem imenu tega mesta: Hafnia, ki je kasneje izpeljal "Hafnio".
Izolacija in proizvodnja
Vendar to ni bila lahka naloga. Čeprav je bila leta 1924 metodo zasnovana z frakcijsko rekristalizacijo za pridobitev hafnio tetraklorid, hfcl4, Nizozemski kemikaliji sta ga Anton Eduard Van Arkel in Jan Hendrik de Boer, ki sta ga zmanjšala na kovinski hafnij.
Da bi to naredili, HFCL4 Zmanjšanje je bilo z uporabo kovinskega magnezija (proces Kroll):
HFCL4 + 2 mg (1100 ° C) → 2 mgcl2 + Hf
Po drugi strani, začenši od Hafnio Tetrayoduro, HFI4, To je upalo, da je trpelo toplotno razgradnjo na žarnici na volframu, na kateri je bil odložen kovinski hafnij, da bi povzročil polikristalni videz (kristalni postopek ali proces Arkel-Boer):
Hfi4 (1700 ° C) → HF + 2 i2
Hafnio struktura
 Hafnio Lokacija v periodični tabeli. Fontana: !Original: AhoteseierVector: Sushant Savla, CC BY-SA 3.0, prek Wikimedia Commons
Hafnio Lokacija v periodični tabeli. Fontana: !Original: AhoteseierVector: Sushant Savla, CC BY-SA 3.0, prek Wikimedia Commons Hafnio, atomi HF, so združeni v zunanje pritisk na kompaktni šesterokotni kristal, HCP, tako kot to počnejo titanijevi in cirkonijevi kovini. Ta kristal Hafnio HCP postane njegova α faza, ki ostane konstantna do temperature 2030 K, ko trpi prehod na β fazo, s kubično strukturo, osredotočeno v telo, BCC.
To se razume, če se toplota "sprosti", kozarec se upošteva in zato se atomi HF trudijo, da se postavijo na tak način, da se njihovo stiskanje zmanjša. Ti dve fazi sta dovolj, da upoštevata polimorfizem hafnija.
Predstavlja tudi polimorfizem, ki je odvisen od visokih pritisk. Faza α in β obstajajo pri tlaku 1 atm; Medtem ko se ω, šesterokotna, a še bolj zapletena faza kot navadna HCP, pojavi, ko pritiski presegajo 40 GPA. Zanimivo je, da ko se pritiski še naprej povečujejo, se β faza ponovno pojavi, najmanj gosta.
Vam lahko služi: seleenhidric kislina (H2SE): kaj je, struktura, lastnosti, uporabeHafnio lastnosti
Fizični videz
Srebrna bela trdna trdna, ki prikazuje temne tone, če ima plast oksida in nitrida.
Molarna masa
178,49 g/mol
Tališče
2233 ° C
Vrelišče
4603 ° C
Gostota
Pri sobni temperaturi: 13,31 g/cm3, biti dvakrat gostejši od okr
Desno na tališču: 12 g/cm3
Fuzijska toplota
27.2 kJ/mol
Toplota za uparjanje
648 kJ/mol
Elektronegativnost
1.3 na lestvici Pauling
Ionizacijske energije
Prvi: 658,5 kJ/mol (HF+ plinasto)
Drugi: 1440 kJ/mol (HF2+ plinasto)
Tretjič: 2250 kJ/mol (HF3+ plinasto)
Toplotna prevodnost
23,0 w/(m · k)
Električna upornost
331 nω · m
Mohs trdota
5.5
Reaktivnost
Če je kovina pula in gori, streljanje iskri pri temperaturi 2000 ° C, nima dovzetnosti za oksidacijo ali vodenje, saj ga tanka plast oksida ščiti. V tem smislu je ena najbolj stabilnih kovin. Pravzaprav ga lahko raztopijo kisline ali močne baze; Z izjemo fluorhorhorhorhorhoric kisline, in halogeni, ki jo lahko oksidirajo.
Elektronska konfiguracija
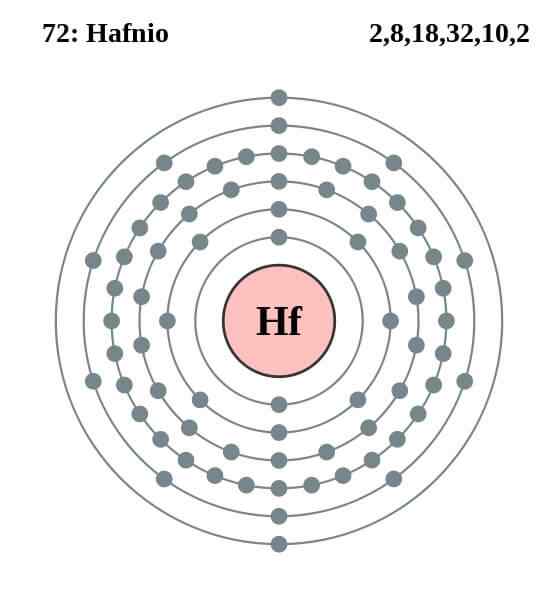 Elektronska konfiguracija Hafnio
Elektronska konfiguracija Hafnio Hafniov atom ima naslednjo elektronsko konfiguracijo:
[Xe] 4f14 5 d2 6s2
To sovpada z dejstvom, da pripada skupini 4 periodične tabele, skupaj s titanom in krogom, ker ima v orbitalih 5D in 6S štiri Valencia elektrone. Upoštevajte, da hafnio ne bi mogel biti lantanoide, saj ima popolnoma polne 4F orbitale.
Oksidacijske številke
Ista elektronska konfiguracija razkriva, koliko elektronov lahko izgubi atom hafnio, ko je del spojine. Ob predpostavki, da izgubi štiri elektrone Valencije, bi bil tetravalentni kation HF4+ (Analogijo z vami4+ in zr4+), Zato bi imel oksidacijsko število +4.
To je v resnici najbolj stabilno in skupno pri njegovih oksidacijskih številkah. Drugi manj pomembni so: -2 (HF2-), +1 (hf+), +2 (hf2+) in +3 (hf3+).
Izotopi
Hafnio je na Zemlji predstavljen kot pet stabilnih izotopov in radioaktivni z zelo velikim življenjem:
-174HF (0,16%, s pol življenja 2 · 10petnajst leta, zato se šteje za praktično stabilno)
-176HF (5,26%)
-177HF (18,60%)
Vam lahko služi: šibke baze-178HF (27,28%)
-179HF (13,62%)
-180HF (35,08%)
Upoštevajte, da ni takšnega izotopa, ki izstopa v izobilju, in to se odraža v povprečni atomski masi Hafnio, 178.49 UMA.
Od vseh radioaktivnih izotopov hafnio, ki skupaj z domorodci skupno 34, 178m2HF je najbolj sporen, ker v svojem radioaktivnem razpadu sprošča gama sevanje, zato bi te atome lahko uporabili kot vojno pištolo.
Uporaba/aplikacije
 Hafnio pokrit s tanko plastjo oksida. Vir: Alchemist-HP (pogovor) (www.PSE-Mendelejew.De), fal, prek Wikimedia Commons
Hafnio pokrit s tanko plastjo oksida. Vir: Alchemist-HP (pogovor) (www.PSE-Mendelejew.De), fal, prek Wikimedia Commons Jedrske reakcije
Hafnio je kovina, ki je odmevna z vlago in visoke temperature, poleg tega, da je odlična absorbenta nevtrona. Zaradi tega se uporablja v tlačnih vodnih reaktorjih, pa tudi pri proizvodnji krmilnih palic za jedrske reaktorje, v katerih prevleke so narejene iz ultrapuro cirku.
Zlitine
Hafnio Atomi lahko integrirajo druge kovinske kristale, da ustvarijo različne zlitine. Za njih je značilno, da so trdovratni in toplotno odporni, zato so namenjeni prostorskim aplikacijam, kot pri gradnji motornih šob za rakete.
Po drugi strani imajo nekatere zlitine in trdne spojine Hafnio posebne lastnosti; kot so njihovi karbidi in Nituros, HFC in HFN, ki so zelo ognjevzdržni materiali. Tantalo in Hafnio Carbide, TA4Hfc5, Z fuzijsko točko 4215 ° C je eden najbolj znanih ognjevzdržnih materialov.
Kataliza
Hafniovi metaliceni se uporabljajo kot organski katalizatorji za sintezo polimelena, kot sta polietilen in polistiren.
Tveganja
Do danes ni znano, kakšen vpliv bi lahko imel HF ioni v našem telesu4+. Po drugi strani, ker jih v naravi najdemo v cirkonijevih mineralih, ne verjamejo, da bi lahko spremenili ekosistem, da svoje soli osvobodijo okolju.
Zdaj je priporočljivo skrbno manipulirati s spojinami hafnio.
Resnična nevarnost hafnio je v delcih njegove fino zmlete trdne snovi, ki lahko gorijo ravno takrat, ko pridejo v stik s kisikom zraka.
To pojasnjuje, zakaj se, ko je polirano, dejanje, ki strga njegovo površino in oddaja čiste kovinske delce, sproščajo pekoče iskre s temperaturo 2000 ° C; to pomeni, da hafnio predstavlja piroporičnost, edino premoženje, ki vključuje ogenj ali resna tveganja za opekline.

