Lastnosti plinov, vedenje, oblika, primeri

- 3912
- 851
- Don Nitzsche
The Plini So vse tiste snovi ali spojine, katerih stanja združevanja so šibke in razpršene, medtem ko so močno odvisno od tlačnih in temperaturnih pogojev, ki jih urejajo. Morda predstavljajo drugo obliko materije, ki je bolj obilna v celotnem vesolju po plazmi.
Na zemlji plini sestavljajo plasti atmosfere, od eksosfere, do troposfere in zraka, ki ga dihamo. Čeprav je plin neviden, če ga širijo veliki prostori, kot je nebo, ga zaznajo gibanje oblakov, zavoji rezil mlina ali izdihani hlapi naših ust v hladnem podnebju.
 Pline lahko opazimo v industrijskih ali domačih dimnikih, pa tudi v dimnih stolpih, ki izhajajo iz vulkanov. Vir: pxhere.
Pline lahko opazimo v industrijskih ali domačih dimnikih, pa tudi v dimnih stolpih, ki izhajajo iz vulkanov. Vir: pxhere. Prav tako ga v okoljskih negativnih vidikih opazimo v črnem dimu izpušnih cevi vozil, v dimnih stebrih stolpov, ki se nahajajo v tovarnah, ali v dimu, dvignjenem, ko gozd gori.
Prav tako se soočajo s plinastimi pojavi, ko se vidijo hlapi, ki zapustijo kanalizacijo, v usodnih požarih močvirja in pokopališč, v kisiku Bubb, ki ga je rastline sprostilo produkt njihove fotosinteze, in celo v Erutes in Modulence.
Kjer koli opazimo plini, to pomeni, da je prišlo do kemijske reakcije, razen če so fiksirani ali asimilirani neposredno iz zraka, glavni vir plinov (površinsko) planeta. Ko se temperature zvišujejo, se bo vsaka snov (kemični elementi) spremenila v pline, vključno s kovinami, kot so železo, zlato in srebro.
Ne glede na kemijsko naravo plinov si vsi delijo skupno veliko razdaljo, ki ločuje njihove delce (atomi, molekule, ione itd.), ki se premikajo kaotično in samovoljno z določenim zvezkom ali prostorom.
[TOC]
Plin
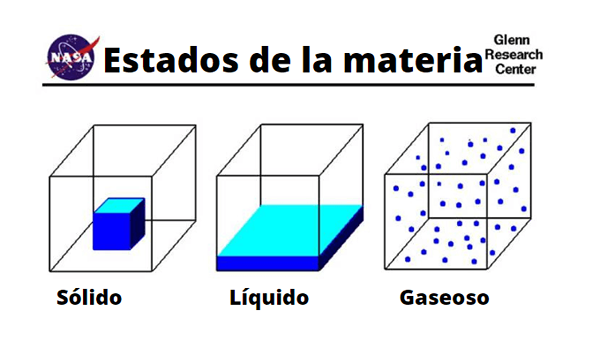 Razlike v molekulah trdnih, tekočih in plinov
Razlike v molekulah trdnih, tekočih in plinov Fizično
Fizikalne lastnosti plinov se razlikujejo glede na to, kaj je snov ali spojina. Popularno so plini povezani s slabimi vonjavami ali gnilobo, zaradi vsebnosti žvepla ali prisotnosti nestanovitnih aminov. Prav tako jih vizualizirajo zelene, rjave ali rumenkaste barve, ki ustrahujejo in dajejo slabo znamenje.
Vendar je večina plinov ali vsaj najpogostejših dejansko brezbarvnih in brez vonja. Tudi če niso prepuščeni, jih lahko čutimo na koži in nasprotujejo odpornosti na gibanje, celo ustvarjajo viskozne plasti v telesih, ki jih prekrižajo (kot pri ravninah).
Vsi plini lahko doživijo tlačne ali temperaturne spremembe, ki na koncu naredijo svoje tekočine; to pomeni, da imajo kondenzacijo (če so ohlajene) ali utekočinjenje (če so "stisnjene").
 Kondenzacija; plinastega stanja do tekočega stanja
Kondenzacija; plinastega stanja do tekočega stanja Po drugi strani se plini lahko raztapljajo v tekočinah in nekaterih poroznih trdnih snovi (na primer aktivirani ogljik). Mehurčki so rezultat plinskih grozdov, ki se na sredini še niso raztopili, in pobegnejo na tekočo površino.
Električna in toplotna prevodnost
V normalnih pogojih (brez ionizacije njihovih delcev) so plini slabi gonilniki toplote in električne energije. Ko pa so napeti z mnogimi elektroni, dovolijo prehod toka skozi njih, kot je razvidno iz žarkov med nevihtami.
Po drugi strani pa se pri nizkih pritiskih in podvrženi električnemu polju nekateri plini, zlasti plemenite ali popolne, osvetljujejo, in njihove luči se uporabljajo za oblikovanje nočnega življenja in plakatov (neonska svetloba), pa tudi v znamenitem električnem udarcu svetilke na uličnih lučeh.
Vam lahko služi: Granataria Balgual: Značilnosti, deli in kako ga uporabljatiKar zadeva toplotno prevodnost, se mnogi plini obnašajo kot toplotni izolatorji, tako da njihova vključitev v polnjenje vlaken, tkiv ali steklenih plošč pomaga preprečiti, da bi jih toplota pripravila in ohranila konstantno temperaturo.
Vendar pa obstajajo plini, ki so dobri toplotni vodniki in lahko povzročijo slabše opekline, ki jih povzročajo tekočine ali trdne snovi; Na primer, tako kot v vroči pari pečenih tort (ali empanad) ali s parnimi curki, ki pobegnejo v kotle.
Reaktivnost
Na splošno so reakcije, ki vključujejo pline ali kjer se pojavljajo, opisane kot nevarne in okorne.
Njegova reaktivnost je spet odvisna od njihove kemijske narave; Vendar pa je treba pri velikem širjenju in mobilizaciji več skrb in nadzora, ker lahko sprožijo drastično povečanje tlaka, ki ogroža strukturo reaktorja; Da ne omenjam, kako vnetljivi ali niso srečni plini.
Obnašanje v roku
Makroskopsko lahko damo predstavo o obnašanju plinov tako, da pričamo, kako se v zraku razvijajo dim, obroči ali literarni "jeziki" cigaret. Tudi ko dimna granata eksplodira, je zanimivo podrobno opisano gibanje teh oblakov različnih barv.

Vendar pa so takšna opažanja podvržena zračnemu delovanju in tudi dejstvo, da so v dimu zelo fini trdni delci suspendirani. Zato ti primeri niso dovolj, da bi dosegli sklep o resničnem vedenju plina. Namesto tega so bili izvedeni poskusi in razvili kinetično teorijo plinov.
Molekularni in v idealnem primeru se plinasti delci elastično trčijo med seboj, z linearnimi, rotacijskimi in vibracijskimi premiki. Imajo povprečno povezano energijo, ki mu omogoča prosto potovanje po katerem koli prostoru, ne da bi skoraj sodelovala ali trčila z drugim delcem, ko se volumen okoli njih povečuje.
Njegovo vedenje bi bila mešanica Brownovega zmotnega gibanja in trkov biljardnih kroglic, ki se nenehno odbijajo drug do drugega in stene mize; Če ni sten, se bodo razširili proti neskončnosti, razen če jih ne bodo obdržali: gravitacija.
Gase oblika
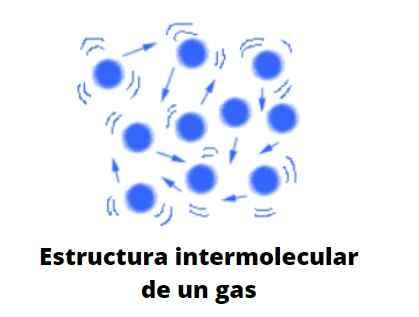
Plini, za razliko od tekočin in trdnih snovi, niso podvrženi kondenziranemu tipu; to pomeni, da združevanje ali kohezija njihovih delcev nikoli ne uspe določiti oblike. S tekočinami delijo dejstvo, da popolnoma zasedajo količino vsebnika, ki jih vsebuje; Vendar jim primanjkuje površinske in površinske napetosti.
Če je koncentracija plina visoka, lahko vaše "jezike" ali makroskopske oblike že opisane. Te prej ali slej bodo na koncu zbledele zaradi delovanja vetra ali zgolj širjenja plina. Plini zato pokrivajo vse kotičke omejenega prostora, ki povzročajo zelo homogene sisteme.
Zdaj teorija priročno obravnava pline kot krogle, ki komaj trčijo vase; Ko pa to storijo, odskočijo elastično.
Te kroglice so zelo ločene drug od drugega, zato so plini praktično "polni" vakuuma; Od tam dolgujete svojo vsestranskost, da prečkate najmanjšo režo ali razpoke, in enostavnost, da jih lahko znatno stisnete.
Vam lahko služi: ne -metalni oksidiZato je, vendar je zaprto namestitev pekarne, če hodite ob strani, gotovo, da bo aroma sveže pečenega kruha uživala.
Plin tlak
Lahko bi verjeli, da s tako raztresenimi in ločenimi plinskimi kroglami ali delci ne morejo ustvariti nobenega pritiska na telesa ali predmete. Vendar atmosfera dokazuje, da je takšno prepričanje napačno: ima maso, tehta in preprečuje, da bi tekočine izzvenele ali vrele iz nič. Vrelišča se merijo pri atmosferskem tlaku.
Pritiski gaze postanejo bolj merljivi, če so na voljo manometri ali če so zaklenjeni iz ne -oblikovanih stenskih posod. Tako je več plinskih delcev znotraj posode, večje je število trkov med njimi in stenami istega.
Ti delci, ko trčijo s stenami. Kot da bi bile idealne biljardne kroglice do stene preobremenjene; Če jih je veliko, ki vplivajo nanje z veliko hitrostjo, bi se lahko prekinili.
Enote
Obstaja veliko enot, ki spremljajo meritve tlaka plina. Nekateri najbolj znani so milimetri živega srebra (MMHG), pa tudi Torr. So tisti iz mednarodnega sistema enot (SI), ki definira Pascal (PA) v smislu N/M2; In od njega, kilo (KPA), Mega (MPA) in Giga (GPA) Pascal.
Volumen plina
Plin zaseda in se širi v celotni količini posode. Večja kot je zabojnik, tudi količina plina bo; Toda njihov tlak in gostota se bosta zmanjšala za isto količino delcev.
Po drugi strani ima sam plin povezan volumen, ki ni toliko odvisen od njegove molekularne narave ali strukture (v idealnem primeru), temveč od tlačnih in temperaturnih pogojev, ki ga urejajo; To je njegov molarni volumen.
V resnici se molarni volumen spreminja od enega plina do drugega, čeprav so razlike majhne, če niso heterogene in velike molekule. Na primer molarni volumen amoniaka (NH3, 22.079 L/mol) Pri 0 ° C in 1 atm se razlikuje od helija (He, 22.435 L/mol).
Vsi plini imajo molsko prostornino, ki se spreminja, odvisno od P in T, in ne glede na to, kako veliki so njihovi delci, je število njih vedno enako. Od tu je izpeljal tisto, kar pozna številka Avogadro (nDo).
Glavni zakoni plinov
Vedenje GASE se uči že od zadnjih stoletij s poskusi, globokimi opazovanji in razlago rezultatov.
Takšni poskusi so omogočili vrsto zakonov, ki so zbrali v isti enačbi (v idealnih plinih), pomagajo napovedati odzive plina na različne tlačne in temperaturne pogoje. Na ta način obstaja povezava med njegovo prostornino, temperaturo in tlakom, pa tudi s številom njihovih molov v določenem sistemu.
Med temi zakoni so naslednji štirje: Boyle, Charles, Gay-Lussac in Avogadro.
Boyle zakon
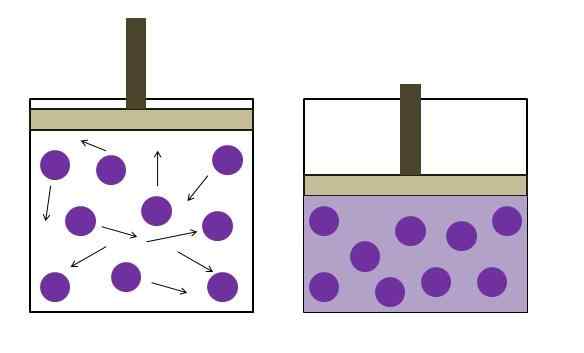 Povečan tlak znižanja tlaka. Vir: Gabriel Bolívar
Povečan tlak znižanja tlaka. Vir: Gabriel Bolívar Boylejev zakon določa, da je pri konstantni temperaturi prostornina idealnega plina obratno sorazmerna z njegovim pritiskom; To je, večji kot je zabojnik, nižji je pritisk, ki ga bodo doživeli njene stene z enako količino plina.
Lahko vam služi: Charles Law: Formule in enote, eksperimentiranje, vajeCharles Law
 Kitajske luči ali želje. Vir: pxhere.
Kitajske luči ali želje. Vir: pxhere. Charlesov zakon določa, da je ob konstantnem tlaku prostornina idealnega plina neposredno sorazmerna s svojo temperaturo. Baloni dokazujejo Charles '.
Zakon o geju-lussaku
Zakon Gay-Lussac določa, da je pri konstantni volumnu tlak idealnega plina neposredno sorazmeren njegovi temperaturi. V dobro zaoblikovanem kotu, če se plin postopoma segreje, vsakič, ko bo tlak v notranjosti večji, ker stene kot kotalca niso deformirane ali razširjene; To pomeni, da se njegova glasnost ne spreminja, je konstantna.
Avogadro zakon
Nazadnje zakon Avogadro ugotovi, da je glasnost, ki jo zaseda idealen plin, neposredno sorazmerna s številom njegovih delcev. Torej, če imate mol delcev (6,02 · 1023), potem bo molarna prostornina plina.
Vrste plinov
Gorljivi plini
To so plini, katerih komponente delujejo kot goriva, ker se uporabljajo za proizvodnjo toplotne energije. Nekateri so zemeljski, utekočinjeni nafti in vodikov plin.
Industrijski plini
To so izdelani plini, ki se tržijo za javnost za različne uporabe in aplikacije, kot so zdravstveni sektorji, hrana, varstvo okolja, metalurgija, kemična industrija, varnost, med drugim. Nekateri od teh plinov so med drugim kisik, dušik, helij, klor, vodik, ogljikov monoksid, propan, metan, dušikov oksid.
Inertni plini
So tisti plini, ki v določenih temperaturnih in tlačnih pogojih ne ustvarjajo nobene kemijske reakcije ali zelo nizke. So neonski, argon, helij, Kripton in Xenon. Uporabljajo se v kemičnih procesih, v katerih so potrebni nereaktivni elementi.
Primeri plinastih elementov in spojin
Kakšni so plinasti elementi periodične tabele v kopenskih pogojih?
Najprej imamo vodik (H), ki tvori molekule H2. Sledi helij (he), lažji plemenit plin; in nato dušik (N), kisik (O) in fluorid (F). Ti zadnji trije tvorijo tudi diatomske molekule: n2, Tudi2 in f2.
Po fluoridu pride neonski (NE), plemenit plin, ki sledi heliju. Pod fluorom imamo klor (CL) v obliki molekul CL2.
Nato imamo preostale plemenite pline: Argon (AR), Kripton (KR), Xenón (XE), Radon (RN) in Oganon (OG).
Zato gre za skupno dvanajst plinastih elementov; enajst, če izključimo zelo radioaktiven in nestabilen Oganoson.
Plinaste spojine
Poleg plinastih elementov bodo navedene tudi nekatere običajne plinaste spojine:
-H2S, vodikov sulfid, odgovoren za vonj po gnilem jajcu
-Nh3, amoniak, ki prodira aroma, ki jo zaznava pri uporabljenih milih
-Co2, Ogljikov dioksid, toplogredni plin
-Ne2, dušikov dioksid
-Ne, dušikov monoksid, plin, za katerega je bil prepričan, da je izjemno strupen, vendar ima pomembno vlogo v obtočnem sistemu
-SW3, Trioksid žvepla
-C4H10, butan
-HCl, vodikov klorid
-Tudi3, ozon
-Sf6, Hexafluoruro iz žvepla
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Lastnosti plinov. Pridobljeno od: chemed.Kem.Purdue.Edu
- Wikipedija. (2019). Plin. Pridobljeno iz: v.Wikipedija.org
- Čelada, Anne Marie, ph.D. (5. december 2018). Plini - splošne lastnosti plinov. Okreval od: Thoughtco.com
- Harvard Men's Health Watch. (2019). Stanje plina. Okrevano od: zdravje.Harvard.Edu
- Elektronični uredniki hlajenja. (1. september 1998). Toplotna prevodnost plinov. Okrevano od: hlajenja elektronike.com
- « Zgodovina demonologije, kakšna študija in znani demonologi
- Grafične nove značilnosti, elementi, primeri »

