Enote ionske sile, kako jo izračunati, primeri

- 5002
- 483
- Adrian Legros
The ionska sila To je način izražanja koncentracije ionov v raztopini. Ta koncept sta leta 1922 uvedla Lewis in Randall, medtem ko sta delala na opisu koeficienta kemične aktivnosti.
Kadar je koncentracija ionov v raztopini visoka, nastane elektrostatična interakcija med nasprotnimi ioni; To pomeni, da so kationi in anioni privlačni, kar ima za posledico učinkovito ali realno ionsko koncentracijo manj kot izračunano za določeno kemijsko reakcijo.
 Ionska sila morske vode je visoka, približno 0.7, zaradi velike koncentracije raztopljenih soli
Ionska sila morske vode je visoka, približno 0.7, zaradi velike koncentracije raztopljenih soli Zaradi tega je bil koncept kemijske aktivnosti uveden kot učinkovita ionska koncentracija raztopine, kemična aktivnost pa je produkt molarnosti raztopine s koeficientom kemijske aktivnosti.
Ta koeficient ima vrednost blizu enote (1) za razredčene ionske raztopine in za tako imenovane idealne rešitve. To so rešitve, pri katerih je medmolekularna interakcija med podobnimi molekulami enaka interakciji med različnimi molekulami.
Ustvarjanje koncepta ionske sile je prispevalo k razlagi odstopanj od idealnega vedenja, ki so ga opazili v resničnih ionskih rešitvah.
[TOC]
Ionske sile
Ionska sila ima kot enote molov/L (molarnost) ali molov/kg vode (molealnost). Slednje je priporočljivo v ne -idealnih rešitvah, ki so značilne, ker količine njihovih mešanic niso popolnoma aditivi.
To pomeni na primer naslednje: če je mešano 0.5 litrov tekočine A in 0.5 litrov tekočine B, posledica volumna te mešanice.
Ionska sila predstavlja simbol i.
Vam lahko služi: butanal: struktura, lastnosti, uporabe in tveganjaKako izračunati ionsko silo?
Za izračun ionske sile raztopine se upošteva koncentracija vseh ionov, prisotnih v raztopini, kot tudi njihove valence.
Vrednost ionske sile dobimo z uporabo naslednje formule:
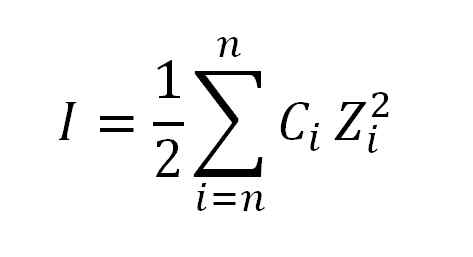 Formula, ki se uporablja za izračun ionske sile. Vir: Gabriel Bolívar.
Formula, ki se uporablja za izračun ionske sile. Vir: Gabriel Bolívar. Kjer sem, kot že rečeno, ionska sila; C, ustreza moralni ionski ali moralni koncentraciji ionov; Medtem ko Z predstavljajo njihove valence (± 1, ± 2, ± 3 itd.).
Izraz, ki se pojavi v formuli v izračunu ionske sile (σ), se bere kot povzetek, to je vsota produkta molarne koncentracije (c) vsakega iona, ki je v raztopini, ki ga je v raztopini, (z) visok kvadrat.
Kot je razvidno, ima valenca iona največjo težo vrednosti ionske sile raztopine. Na primer: Valencia (z) CA je +2, torej z2 Je isto 4. Medtem Valencia (z) Na es +1 in zato z2 Je isto 1.
To poudarja, da je prispevek ion ca2+ Na vrednost ionske sile je v isto molsko ionsko koncentracijo štirikrat večja od vrednosti Na iona+.
Pomen ionske sile
Ionska sila je ustrezno merilo ionske koncentracije raztopine in je osnova za vzpostavitev teorije Debye-Hückel. Ta teorija opisuje idealno vedenje ionskih rešitev.
Ionska sila služi kot osnova za izračun koeficienta aktivnosti (γYo), parameter, ki posledično omogoča izračun kemijske aktivnosti ionske spojine, pri čemer je kemična aktivnost učinkovita in realna koncentracija ionske spojine v raztopini.
Vam lahko služi: aluminijev acetat (al (ch3coo) 3): struktura, lastnosti, uporabeS povečanjem ionske sile raztopine se interakcija med ioni poveča. Zato zmanjšanje γYo in kemično aktivnost ionov.
Povečanje ionske sile lahko zmanjša topnost beljakovin v vodnem okolju, pri čemer se ta lastnost selektivno uporablja za padavine beljakovin. Za padavine in čiščenje plazemskih beljakovin se uporabljajo raztopine sulfatnih ionskih sil z visoko silo.
Primeri ionskih sil
Primer 1
Izračunajte ionsko silo raztopine kalijevega klorida (KCL) 0.3 m.
KCL disociira na naslednji način:
KCl → k+ + Cl-
Imamo dva iona: k kation+ (Z =+1) in cl anion- (Z = -1). Nato uporabimo formulo za izračun ionske sile I:
I = 1/2 [c · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 11 + 0.3 m · 11]
= 0.3 m
Upoštevajte, da valencia -1 CL- Je bila vzeta kot 1, njegova absolutna vrednost, saj bi bila ionska sila enaka 0.
Primer 2
Izračunajte ionsko silo raztopine kalcijevega sulfata (primer4) 0.5m
Primer4 Disociira na naslednji način:
Ovitek4 → ca2+ + SW42-
Imamo dva iona: cation2+ (Z =+2) in tako anion42- (Z = -2). Nato uporabimo formulo za izračun ionske sile I:
I = 1/2 [c · (+2)2 + C · (-2)2]
= 1/2 [0,5 m · 4 +0,5 m · 4]
= 2 m
Primer 3
Izračunajte ionsko silo amorterja s končnimi koncentracijami dibasičnega natrijevega fosfata (NA2HPO4) 0.3 m in monobazični natrijev fosfat (Nah2Po4) 0.4 m.
Na2HPO4 Disociira na naslednji način:
Vam lahko služi: arsenova kislina (H3SO4): lastnosti, tveganja in uporabeNa2HPO4 → 2+ + HPO42-
Medtem ko Nah2Po4 Disociira po naslednjem vzorcu:
Ne2Po4 → NA+ + H2Po4-
Nadaljujemo kot prejšnje vaje, tokrat imamo anione HPO42- (Z = -2) in h2Po4- (Z = -1):
I = 1/2 [c · 2 · (+1)1 + C · (-2)2] +[C · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 2 · 1 +0.3 m · 4] +[0.4 m · 1 +0.4 m · 1]
= 1/2 [0.6 m +1.2 m] +[0.4 m +0.4 m]
= 1.3 m
Upoštevajte, da je koncentracija NA+ od Na2HPO4 Pomnoži se z 2, saj je njegova koncentracija dvojna. Vendar pa za drugo sol, ne2Po4, Koncentracija Na+ Da, pomnožimo ga za 1, v skladu s stehiometrijo njegove enačbe raztapljanja.
Primer 4
Izračunajte ionsko silo raztopine natrijevega klorida (NaCl) 0.15 m in glukoza (c6H12Tudi6) 0.3 m.
NaCl disociira na naslednji način:
NaCl → NA+ + Cl-
Glukoza pa na ionih ni disocirana, ker ima v svoji kemijski strukturi le kovalentne vezi tipa. Zato je Valencia de la glucoza (z) enaka nič (0). Nato izračunamo ionski produkt NaCl:
I = 1/2 [c · (+1)1 + C · (-1)1]
= 1/2 [0.15 m · 1 +0.15 m · 1]
= 0.15 m
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Wikipedija. (2020). Ionska moč. Pridobljeno iz: v.Wikipedija.Ali
- Doktor. David K. Ryan. (s.F.). Dejavnost in ionska moč razreda 4 Ryan. [PDF]. Pridobljeno od: facy.uml.Edu
- Univerza v Michiganu. (s.F.). Podrobnejši pogled na kemično ravnovesje. [PDF]. Okreval od: Umich.Edu
- Elsevier b.V. (2020). Ionska moč. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- C.D. Kennedy. (1990). Ionska stena in dizociacija kislin. [PDF]. Okreval od: iubmb.Spletna knjižnica.Wiley.com

