Kalcijev fosfat (CA3 (PO4) 2)

- 2590
- 61
- Stuart Armstrong
On Kalcijev fosfat Gre za anorgansko in terciarno sol, katere kemična formula je CA3(Po4)2. Formula določa, da je sestava te soli 3: 2 za kalcij oziroma fosfat. To je razvidno neposredno na spodnji sliki, kjer je prikazana kation2+ in anion po43-. Za vsake tri ca2+ Obstajata dva PO43- interakcijo z njimi.
Po drugi strani se kalcijev fosfat nanaša na vrsto soli, ki se razlikujejo glede na razmerje Ca/P, pa tudi na stopnjo hidracije in pH. Pravzaprav obstaja veliko vrst kalcijevih fosfatov, ki obstajajo in jih je mogoče sintetizirati. Vendar po črki nomenklatura, kalcijev fosfat aludira le na tricični, zgoraj omenjeni.
 Delež in ioni v tricikalnem fosfatu. Vir: Richard-59 [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)], iz Wikimedia Commons
Delež in ioni v tricikalnem fosfatu. Vir: Richard-59 [CC BY-SA 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)], iz Wikimedia Commons Vsi kalcijevi fosfati, vključno s CA3(Po4)2, So bele trdne snovi z rahlo sivimi toni. Lahko so zrnate, fine, kristalne in imajo velikosti delcev, ki so okoli mikrometrov; In celo nanodelci teh fosfatov so pripravljeni, s katerimi so zasnovani biokompatibilni materiali za kosti.
Ta biokompatibilnost je zato, ker te soli najdemo v zobeh in na kratko v kostnih tkivih sesalcev. Na primer, hidroksiapatit je kristalni kalcijev fosfat, ki posledično vpliva na amorfno fazo iste soli.
To pomeni, da obstajajo fosfati amorfnih in kristalnih kalcijev. Zaradi tega ni presenetljivo raznolikost in več možnosti pri sintezaciji materialov, ki temeljijo na kalcijevih fosfatih; Materiali, v katerih lastnosti vsak dan bolj zainteresirani raziskovalci po vsem svetu, se osredotočajo na obnovo kosti.
Struktura kalcijevega fosfata
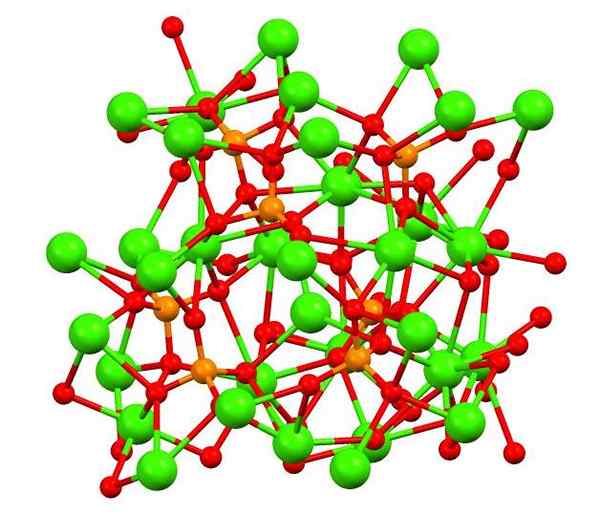 Kalcijev fosfat v mineralu Whitlockita. Vir: Smokefoot [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)], iz Wikimedia Commons
Kalcijev fosfat v mineralu Whitlockita. Vir: Smokefoot [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)], iz Wikimedia Commons Zgornja slika prikazuje strukturo tribaznega kaličnega fosfata v čudnem mineralu Whitlockita, ki lahko vsebuje magnezij in železo kot nečistoče.
Čeprav se na prvi pogled morda zdi zapleteno, je treba razjasniti, da model predpostavlja kovalentne interakcije med kisikovimi atomi fosfatov in kalcijevih kovinskih središčih.
Vam lahko služi: berilski hidrid (beh2)Kot predstavitev je veljavna, vendar so interakcije elektrostatične; torej kationi2+ Občutite privlačnost za PO43- (Ac2+- O-po33-). Glede na to se razume, zakaj so na sliki kalcij (zelene kroglice) obdane z negativno nabitimi atomi kisika (rdeče krogle).
Ko je toliko ionov, simetrična ureditev ali vzorec ne pusti vidni. Ca3(Po4)2 sprejema pri nizkih temperaturah (t<1000°C) una celda unitaria correspondiente a un sistema cristalino romboédrico; a este polimorfo se le conoce con el nombre de β-Ca3(Po4)2 (β-TCP, za kratico v angleščini).
Po drugi strani pri visokih temperaturah postane polimorf α-CA3(Po4)2 (α-TCP), katere enotna celica ustreza monokliničnemu kristalnemu sistemu. Pri še višjih temperaturah lahko tvorimo tudi α'-CA polimorf3(Po4)2, ki je šesterokotna kristalna struktura.
Amorfni kalcijev fosfat
Omenjene so bile kristalne strukture za kalcijev fosfat, kar pričakuje od soli. Vendar je to sposobno prikazati.
Ko se to zgodi, se reče, da ima kalcijev fosfat amorfno strukturo (ACP, Amorfni kalcijev fosfat). Več avtorjev opozarja na to vrsto strukture kot odgovorne za biološke lastnosti CA3(Po4)2 V kostnih tkivih je možno popravilo in biomimetizacija.
Preostali del družine
Kalcijevi fosfati so v resnici družina anorganskih spojin, ki lahko medsebojno vplivajo na organsko matrico.
Drugi fosfati dobimo "preprosto" spreminjanje anionov, ki spremljajo kalcij (PO43-, HPO42-, H2Po4-, Oh-), kot vrsta nečistoč v trdni snovi. Tako lahko do enajst kalcija ali več fosfatov, vsak s svojo strukturo in lastnostmi, izvira iz naravno ali umetno.
Spodaj bodo omenjeni nekateri fosfati in njihove kemijske strukture in formule:
-Vodik dihidrado kalcijev fosfat, Cahpo4∙ 2H2O: Monoklinic.
Vam lahko služi: amonijev oksalat-Dihidrogen monohidriran kalcijev fosfat, CA (H2Po4)2∙ h2O: Triklinična.
-Brezvodni dease fosfat, CA (H2Po4)2: Triclinic.
-Vodikov oktakalcični fosfat (OCP), CA8H2(Po4)6: Triclinic. Je predhodnik sinteze hidroksiapatita.
-Hidroksiapatit, ca5(Po4)3OH: Šesterokotni.
Fizikalne in kemijske lastnosti
Imena
-Kalcijev fosfat
-Tricalcium fosfat
-Trikalni difosfat
Molekularna teža
310,74 g/mol.
Fizični opis
Je bela trdna.
Okus
Brez okusa.
Tališče
1670 ° K (1391 ° C).
Topnost
-Praktično netopna v vodi.
-Netopna v etanolu.
-Topno v klorovodikovi in razredčeni dušikovi kislini.
Gostota
3.14 g/cm3.
Lomni količnik
1.629
Standardna entalpija treninga
4126 kcal/mol.
Temperatura skladišča
2-8 ° C.
ph
6-8 v vodni suspenziji 50 g/l kalcijevega fosfata.
Usposabljanje
Amonijev fosfat kalcijevega in vodikovega nitrata
Obstajajo številne metode za proizvodnjo ali oblikovanje kalcijevega fosfata. Ena od njih je sestavljena iz mešanice dveh soli, Kalifornija (ne3)2∙ 4H2Ali in (nh4)2HPO4, prej raztopljen v absolutnem alkoholu in vodi. Ena sol prispeva kalcij, drugi pa fosfat.
Iz te mešanice obori ACP, ki se nato ogreva v pečici pri 800 ° C in 2 uri. Kot rezultat tega postopka dobimo β-CA3(Po4)2. Previdno nadzorovanje temperatur, vznemirjenosti in časov stikov, lahko pride do tvorbe nanokristal.
Oblikovati α-CA polimorf3(Po4)2 Potrebno je segreti fosfat nad 1000 ° C. To segrevanje se izvaja v prisotnosti drugih kovinskih ionov, ki to polimorfu dovolj stabilizirajo, da se lahko uporablja pri sobni temperaturi; to pomeni, da ostaja v stabilnem ciljnem stanju.
Kalcijev hidroksid in fosforna kislina
Kalcijev fosfat lahko tvorimo tudi z mešanjem raztopin kalcijevega hidroksida in fosforjeve kisline, ki se pojavljajo nevtralizacija kislinske baze. Po pol dneva zorenja v materinih duhovih in njihovi dolžni filtraciji, pranju, sušenju in presejanju, zrnatem prahu amorfnega fosfata, dobimo ACP.
Ta produkt ACP reakcije visokih temperatur, ki se preoblikuje v skladu z naslednjimi kemičnimi enačbami:
2CA9(HPO4) (Po4)5(OH) => 2CA9(P2Tudi7)0,5(Po4)5(OH) + H2O (a t = 446,60 ° C)
2CA9(P2Tudi7)0,5(Po4)5(OH) => 3CA3(Po4)2 + 0,5H2O (a t = 748,56 ° C)
Vam lahko služi: Selenium: Zgodovina, lastnosti, struktura, pridobivanje, uporabeNa ta način dobimo β-ca3(Po4)2, Vaš najpogostejši in stabilen polimorf.
Prijave
V kostnem tkivu
Ca3(Po4)2 Je glavna anorganska sestavina kostnih pepela. Gre.
Biomateriali kalcijevega fosfata se uporabljajo za odpravljanje okvar kosti in pri prekrivanju kovinskih protez. Na njih se odloži kalcijev fosfat, izolira jih iz okolja in upočasni proces korozije titana.
Bioceramični cementi
Kalcijev fosfatni cement (CPC) je še ena bioceramika, ki se uporablja pri popravilu kostnega tkiva. Izdelan je z mešanjem prahu različnih vrst kalcijevih fosfatov z vodo, ki tvori pasto. Testenine je mogoče vbrizgati ali prilagoditi okvari ali votlini kosti.
Cementi so oblikovani, postopoma ponovno absorbirajo in jih nadomestijo na novo oblikovana kost.
Zdravniki
-Ca3(Po4)2 To je osnovna sol, zato se uporablja kot antacid za nevtralizacijo odvečne kislosti želodca in povečanje pH. V zobnih testeninah dobavlja vir kalcija in fosfata, da olajša proces remineralizacije zob in kostne hemostaze.
-Uporablja se tudi kot prehransko dopolnilo, čeprav je najbolj ekonomičen način oskrbe s kalcijam z uporabo karbonata in citrata.
-Kalcijev fosfat se lahko uporablja pri zdravljenju tetanije, latentne hipokalcemije in vzdrževalne terapije. Poleg tega je uporaben pri dopolnjevanju kalcija med nosečnostjo in dojenjem.
-Uporablja se pri zdravljenju kontaminacije z radioaktivnim izotopom radiom (RA-226) in stroncija (SR-90). Kalcijev fosfat blokira absorpcijo radioaktivnih izotoposov v prebavnem traktu in tako omeji škodo, ki jo je povzročil.
Drugi
-Kalcijev fosfat se uporablja kot krma za ptice. Poleg tega se uporablja v zobnih pastah pri nadzoru tatarca.
-Uporablja se kot anti -gomerantno sredstvo, na primer, da prepreči, da bi bila namizna sol kompaktna.
-Deluje kot belilni agent moke. Medtem v Cochino Butter preprečuje neželeno obarvanost in izboljša stanje cvrtja.
Reference
- Kalcijev fosfat. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Kalcijev fosfat. Znanost Direct. Pridobljeno iz: SCINCEDIRECT.com

