Litijeva fluoridna struktura, lastnosti, pridobivanje, uporabe

- 4585
- 195
- Adrian Legros
On Litijev fluorid Gre za anorgansko trdno snov, katere kemična formula je Lif. Tvori li ioni+ in f- ki so združeni z ionsko vezjo. Najdemo ga v majhnih količinah v več mineralih, zlasti silikatih, kot so lepidolit, morska voda in v številnih mineralnih vrtinah.
Na optičnih napravah je imel široko uporabo zaradi preglednosti v širokem razponu valovnih dolžin, od infrardečega spektra (IR) do UV ultravijoličnega.
 Lepidolit, mineral, ki vsebuje majhne količine ličnega fluorida. Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Lepidolit, mineral, ki vsebuje majhne količine ličnega fluorida. Rob Lavinsky, Irocks.com-cc-by-sa-3.0 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. Uporablja se tudi na napravah za odkrivanje nevarnega sevanja na delovnih mestih, v katerih so ljudje za kratek čas izpostavljeni. Poleg tega se uporablja kot material za taljenje aluminija ali za izdelavo kozarcev ali kozarcev steklo in keramično proizvodnjo.
Služi kot material za pokrivanje komponent litij -ionskih baterij in za preprečevanje začetne izgube nalaganja le -teh.
[TOC]
Struktura
Litijev fluorid je ionska spojina, torej oblikovana z združitvijo litine+ in anion f-. Sila, ki jih ohranja skupaj, je elektrostatična in se imenuje ionska vez.
Ko se litij združi, daje elektron fluoridu, oba sta stabilnejša od začetnega načina, kot je razloženo spodaj.
Litijev element ima naslednjo elektronsko konfiguracijo: [on] 1S2 2s1 In pri dajanju elektrona je elektronska struktura takšna: [on] 1s2 ki je veliko bolj stabilen.
Fluorijski element, katerega elektronska konfiguracija je: [NE] 1S2 2s2 2 p5, S sprejemanjem elektrona je oblika [ne] 1s2 2s2 2 p6, bolj stabilen.
Nomenklatura
- Litijev fluorid
- Fluorolitio
Vam lahko služi: ne -metalni oksidi- Litijev monofluorid
Lastnosti
Fizično stanje
Bela trdna trdna snov, ki kristalizira v kubični strukturi, kot je natrijev klorid NaCl.
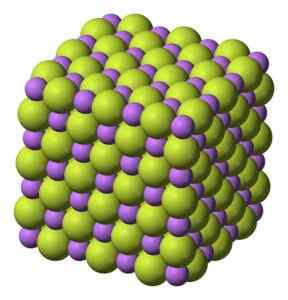 Kubična struktura kristalov litijevega fluorida litije. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons.
Kubična struktura kristalov litijevega fluorida litije. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons. Molekularna teža
26 g/mol
Tališče
848,2 ° C
Vrelišče
1673 ° C, čeprav je hlapljivo pri 1100-1200 ° C
Gostota
2.640 g/cm3
Lomni količnik
1.3915
Topnost
Malo topno v vodi: 0,27 g/100 g vode pri 18 ° C; 0,134 g/100 g pri 25 ° C. Topno v kislem mediju. Netopna v alkoholu.
Druge lastnosti
Njeni hlapi imajo dimične vrste (lif)2 in trimerično (lif)3. S hf fluorhorhorhorhorhorhorhor kislina tvori lihf litij2; Z litijevim hidroksidom tvori dvojno sol Lif.Lioh.
Pridobivanje in lokacija
Lif litijev fluorid lahko dobimo z reakcijo med fluorhorinsko kislino HF in litijevim hidroksidom lioh ali litijevim litijevim karbonatom2Co3.
Vendar je prisotna v majhnih količinah v nekaterih mineralih, kot sta lepdolit in morska voda.
 Litijev fluorid najdemo v majhnih količinah v morski vodi. Adeeb atwan [cc do 3.0 (https: // creativeCommons.Org/licence/by/3.0)]. Vir: Wikimedia Commons.
Litijev fluorid najdemo v majhnih količinah v morski vodi. Adeeb atwan [cc do 3.0 (https: // creativeCommons.Org/licence/by/3.0)]. Vir: Wikimedia Commons. Prijave
V optičnih aplikacijah
Lif se uporablja v obliki kompaktnih kristalov v infrardečih spektrofotometrih (IR) zaradi odlične disperzije, ki jo imajo v intervalu valovne dolžine med 4000 in 1600 cm-1.
Kristali LIF Lif dobimo iz nasičenih raztopin iz te soli. Lahko nadomesti naravne kristale fluorita v različnih vrstah optičnih naprav.
Veliki in čisti kristali se uporabljajo v optičnih sistemih za ultravijolično svetlobo (UV), vidne in IR in rentgenske monokromatorje (0,03-0,38 nm).
 Life Lif fluoruro kristal, znotraj čaše. V1Adis1AV [javna domena]. Vir: Wikimedia Commons.
Life Lif fluoruro kristal, znotraj čaše. V1Adis1AV [javna domena]. Vir: Wikimedia Commons. Uporablja se tudi kot optični material za prevleko za UV regijo zaradi širokega optičnega pasu, večjega kot pri drugih kovinskih fluoridih.
Lahko vam služi: alkalinoterne kovineNjegova preglednost v oddaljenem UV (90-200 nm) je idealna kot zaščitna prevleka v aluminijastih ogledalih (AL). Ogledala Lif/Al imajo v optičnih teleskopskih sistemih za vesoljske aplikacije.
Te prevleke dosežemo s fizičnim odlaganjem pare in nalaganja plasti na atomski ravni.
Pri ionizirajočih ali nevarnih detektorjih sevanja
Litijev fluorid se pogosto uporablja pri termoluminescentnih detektorjih za fotone, nevtronske in β (beta) sevanje.
Termoluminescentni detektorji ohranjajo energijo sevanja, ko so to izpostavljeni. Kasneje, ko jih segrevanje sprosti energijo, shranjeno v svetlobi.
Za to aplikacijo je LIF na splošno datiran z magnezijevimi nečistočami (MG) in titanom (TI). Te nečistoče ustvarjajo določene ravni energije, ki delujejo kot luknje, kjer so elektroni, ki se sprostijo z sevanjem. Ko se je material nato segreval, se ti elektroni vrnejo v prvotno energijsko stanje, ki oddaja svetlobo.
Intenzivnost izpuščene svetlobe je neposredno odvisna od energije, ki jo absorbira material.
Termoluminescentni detektorji LIF so bili uspešno preizkušeni za merjenje zapletenih sevalnih polj, kot so prisotni v velikem Hadron Colliderju ali LHC (za svojo kratico za angleščino Veliki hadronski trk), ki se nahaja v Evropski organizaciji za jedrske raziskave, znano kot CERN (za svojo kratico francoščine Conseil Européen nalije Recherche Nucleaire).
Sevanje v izkušnjah, opravljenih v tem raziskovalnem centru, med drugimi vrstami subatomskih delcev predstavljajo hadrone, nevtrone in elektrone/pozitrone, ki jih je mogoče zaznati z LIF.
Kot material za predhodno katodo litijeve baterije
Lif je bil uspešno preizkušen v obliki nanokompozitov s kobaltom (CO) in železom (vero) kot materialom za uvodnega (prevod angleščine Prelitiation) materiala za katodno katodo litij -ion.
Vam lahko služi: etilni eterMed prvim ciklom obremenitve ali fazo tvorbe litijeve ionske baterije se organski elektrolit razgradi, da tvori trdno fazo na površini anode.
Ta postopek porabi litij katode in zmanjšuje energijo med 5 na 20% celotne zmogljivosti litij ionske baterije.
Zaradi tega je bila raziskana elektrokemična uvod v katodo, ki ustvarja elektrokemično ekstrakcijo litija nanokomposenega, ki deluje kot litijev darovalec, s čimer se izogne porabi litija katode.
Nanokompoziti Lif/CO in LIF/FE imajo veliko zmogljivost za darovanje litija katoda.
 Litij ionska baterija. Avtor: g.ちゅら さん さん. Lithium_battery * Dan fotografije, avgust 2005 * Fotografska oseba Aney. Vir: Wikimedia Commons.
Litij ionska baterija. Avtor: g.ちゅら さん さん. Lithium_battery * Dan fotografije, avgust 2005 * Fotografska oseba Aney. Vir: Wikimedia Commons. V več uporabi
Litijev fluorid se uporablja kot merilnik varjenja, zlasti aluminij, in pri varilnih palicah. Uporablja se tudi v celicah za redukcije aluminija.
Široko se uporablja pri izdelavi stekla (na primer tistih leč), v katerem se koeficient razširitve zmanjšuje. Uporablja se tudi v proizvodnji keramike. Poleg tega je uporabila pri izdelavi emajlov in steklastih lakov.
Lif je sestavni del goriva za rakete in goriva za nekatere vrste reaktorjev.
Lif se uporablja tudi v diodah, ki oddajajo svetlobo ali fotovoltaičnih komponentah, za vbrizgavanje elektronov v notranje plasti.
Reference
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Ali.S. Nacionalna knjižnica medicine. (2019). Fluorid litij. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Obryk, b. et al. (2008). Odziv različnih vrst detektorjev TL litijevega fluorida na visoko-energijsko mešano sevanje. Meritve sevanja 43 (2008) 1144-1148. Okrevano od Scientirect.com.
- Sonce in. et al. (2016). V pravočasni kemični sintezi litijevega fluorida/kovinskega nanokompozita za predhodno predhodno zmogljivost katod. Nano Letters 2016, 16, 2, 1497-1501. Okrevani iz lokalov.Acs.org.
- Hennessy, J. in Nikzad, s. (2018). Atomska plast nalaganje litijevih fluoridnih optičnih premazov za ultravijolični. Anorganics 2018, 6, 46. MDPI se je okreval.com.
- « 10 znanstvenih poskusov za fizikalno sekundarno, kemijo, biologijo
- Struktura metilmalonske kisline, lastnosti, sinteza, uporablja »

