Dejavniki, ki vplivajo na topnost
- 4408
- 440
- Cary Goyette
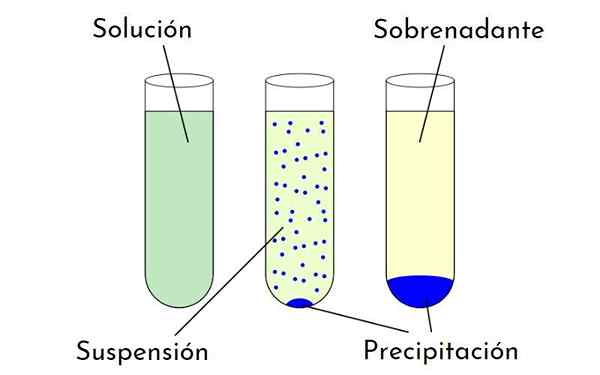
 Diagram, ki prikazuje razlike med raztopino, suspenzijo in padavinami, ki tvorijo oborino in supernatantom. Vir: Zabmilenko: Orninalzofari: VectormRMW: Optimiziran, Multilang, Wikimedia Commons
Diagram, ki prikazuje razlike med raztopino, suspenzijo in padavinami, ki tvorijo oborino in supernatantom. Vir: Zabmilenko: Orninalzofari: VectormRMW: Optimiziran, Multilang, Wikimedia Commons Kateri so dejavniki, ki vplivajo na topnost?
Glavno Dejavniki, ki vplivajo na topnost So polarnost, učinek skupnega iona, temperature, tlaka, topne narave in mehanskih dejavnikov. Topnost je sposobnost trdne, tekoče ali plinaste kemikalije (imenovane topilo), da se raztopi v topilu (običajno tekočina) in tvori raztopino.
Topnost snovi je v bistvu odvisna od uporabljenega topila, pa tudi temperature in tlaka. Topnost snovi v določenem topilu se meri s koncentracijo nasičene raztopine.
Raztopina se šteje za nasičeno, ko dodajanje dodatnega topka ne poveča več koncentracije raztopine.
Stopnja topnosti se zelo razlikuje glede na snovi, od neskončno topnega (popolnoma mešljivega), kot je etanol v vodi, do malo topnega, kot srebrni klorid v vodi. Izraz "netopen" pogosto velja za malo topne spojine.
Nekatere snovi so topne v vseh razmerjih z določenim topilom, kot je etanol v vodi. Ta lastnost je znana kot mešljivost.
V različnih pogojih je mogoče premagati ravnotežno topnost, da dobimo rešitev, imenovano nadnasiščeno.
Glavni dejavniki, ki vplivajo na topnost
1. Polarnost
V večini primerov se topili raztopijo v topilih, ki imajo podobno polarnost. Kemiki uporabljajo priljubljen aforizem za opis te značilnosti topila in topil: "Podobno raztopi podobno".
Ne -polarni topili se ne raztopijo v polarnih topilih in obratno.
2. Skupni ionski učinek
Skupni ionski učinek je izraz, ki opisuje zmanjšanje topnosti ionske spojine, ko sol mešanici dodamo ion, ki že obstaja v kemični tehtnici.
Ta učinek je najbolje razložiti načelo Le Châtelierja. Predstavljajte si, če sestavljeni kalcijev sulfat rahlo topen, ohišje4, Doda se v vodo. Neto ionska enačba za nastalo kemično ravnovesje je naslednja:
Primera4 (s) ⇌ca2+(aq)+SO42− (aq)
Kalcijev sulfat je rahlo topen. V ravnovesju večina kalcija in sulfata trdno obstaja kalcijevega sulfata.
Lahko vam služi: iarhidric kislina (HI): struktura, lastnosti in uporabeRecimo, da ionski spojini topni bakreni sulfat (CUO4) V rešitev je bil dodan. Bakreni sulfat je topen. Zato je njegov edini pomemben učinek na neto ionsko enačbo dodajanje več sulfatnih ionov (tako42-).
CuSO4 (s) ⇌CU2+(aq)+SO42− (aq)
Disociirani sulfatni ioni bakrenega sulfata so že prisotni (pogosti A) v mešanici iz rahle disociacije kalcijevega sulfata.
Zato ta dodajanje sulfatnih ionov poudarja predhodno uveljavljeno ravnovesje.
Načelo Le Catelierja narekuje, da dodatni napor na tej strani izdelka za ravnotežje povzroči spremembo ravnotežja na stran reaktantov za lajšanje te nove napetosti.
Zaradi spremembe na reakcijsko stran se topna topna topnost kalcijevega sulfata še dodatno zmanjša.
3. Temperatura
Temperatura neposredno vpliva na topnost. Pri večini ionskih trdnih snovi povečanje temperature poveča hitrost, s katero je mogoče narediti raztopino.
Ko se temperatura povečuje, se trdni delci premikajo hitreje, kar poveča možnosti interakcije z več delci topila. To ima za posledico povečanje hitrosti, s katero se pojavi rešitev.
Temperatura lahko tudi poveča količino topljene, ki jo lahko raztopimo v topilu. Na splošno, ko se temperatura povečuje, se raztopi več topnih delcev.
Na primer, ko se sladkor doda v vodo, je enostavno narediti rešitev. Ko se ta raztopina segreva in še vedno dodamo sladkor.
Razlog, da se to zgodi, je, da se s povečanjem temperature medmolekulske sile lažje razbijejo, kar omogoča, da se delci topila pritegnejo več topnih delcev.
Vam lahko služi: magnezij: zgodovina, struktura, lastnosti, reakcije, uporabeObstajajo tudi drugi primeri, kjer zvišanje temperature zelo malo vpliva na količino topljene, ki jo je mogoče raztopiti.
Namizna sol je dober primer: v vreli vodi lahko raztopite skoraj enako količino namizne soli, ki jo lahko.
Za vse pline, ko se temperatura povečuje, se topnost zmanjšuje. Kinetična molekularna teorija lahko uporabimo za razlago tega pojava.
Ko se temperatura zvišuje, se molekule plina hitreje premikajo in se lahko izognejo tekočini. Nato se topnost plina zmanjša.
4. Pritisk
Četrti faktor, tlak, vpliva na topnost plina v tekočini, vendar nikoli s trdno snovjo, ki se raztopi v tekočini.
Ko se tlak uporablja na plin, ki je nad površino topila, se bo plin premaknil v topilo in zasedel nekaj presledkov med delci topila.
Dober primer je gazirana soda. Tlak se uporablja za prisilno molekule v soda. Prav tako je ravno nasprotno. Ko se tlak plina zmanjšuje, se tudi topnost tega plina zmanjša.
Ko se odpre pijača pijača s sodo, se spusti pritisk v soda, zato se plin takoj začne izvleči iz rešitve.
Ogljikov dioksid, shranjen v soda. Če odprta pločevinka sode ostane za nekaj časa, lahko opazimo, da pijača postane ravno zaradi izgube ogljikovega dioksida.
Ta faktor tlaka plina je izražen v Henryjevem zakonu. Henryjev zakon ugotovi, da je pri določeni temperaturi topnost plina v tekočini sorazmerna z delnim tlakom plina na tekočini.
Lahko vam služi: Običajne rešitve: koncept, priprava, primeriPrimer Henryjevega zakona je nastajan pri potapljanju. Ko se človek potopi v globoko vodo, se tlak poveča in več plinov se raztopi v krvi.
Medtem ko se dviga iz globoke vode, se mora potapljač vrniti na površino z zelo počasno hitrostjo, da lahko vsi raztopljeni plini zapustijo kri zelo počasi.
Če se oseba prehitro vzpenja, se lahko pojavi nujna medicinska pomoč zaradi plinov, ki prehitro prihajajo iz krvi.
5. Narava topka
Narava topila in topila ter prisotnost drugih kemičnih spojin v raztopini vplivajo na topnost.
Na primer, v vodi lahko raztopite večjo količino sladkorja, ki izhaja v vodi. V tem primeru je rečeno, da je sladkor bolj topen.
Etanol v vodi sta popolnoma topna drug z drugim. V tem konkretnem primeru bo topilo spojina, ki je v večji količini.
Pomemben dejavnik je tudi velikost topljenca. Večje kot so molekule topljene, večja je molekulska teža in njegova velikost. Molekule topila je težje obkrožiti večje molekule.
Če so izključeni vsi zgoraj omenjeni dejavniki, je mogoče najti splošno pravilo, da so največji delci na splošno manj topni.
Če sta tlak in temperatura enaka kot med dvema topiloma iste polarnosti, je tista z manjšimi delci običajno bolj topna.
6. Mehanski dejavniki
V nasprotju s hitrostjo raztopine, ki je odvisna predvsem od temperature, je hitrost rekristalizacije odvisna od koncentracije topljenosti na površini kristalnega omrežja, kar je naklonjeno, ko je rešitev brez gibanja.
Zato se vznemirjenost raztopine izogne temu kopičenju in maksimira rešitev.
Reference
- Topnost. Okrevano od meja.com.
- Dejavniki, ki prinašajo topnost. Okreval od CK12.org.
- Izobraževanje na spletu.F.). Dejavniki, ki prinašajo topnost. Pridobljeno iz topnosti.com.

