Struktura faktorja nekroze tumorja (TNF), mehanizem delovanja, delovanje
- 1549
- 340
- Percy Feeney
On Faktor nekroze tumorja (TNF), znan tudi kot kaquektin, je naravno proizveden protein v fagocitskih ali makrofaških celicah človeškega telesa in drugih živali sesalcev. To je zelo pomemben citokin, ki sodeluje tako v normalnih fizioloških procesih kot tudi v raznolikosti telesnih patoloških procesov.
Njegovo odkritje izvira iz nekaj več kot 100 let, ko w. Coley je za zdravljenje tumorjev pri različnih bolnikih uporabil surove bakterijske izvlečke in ugotovil, da imajo ti izvlečki sposobnost induciranja nekroze teh tumorjev, hkrati pa sprožijo sistemsko vnetno reakcijo pri bolnikih pri bolnikih pri bolnikih.
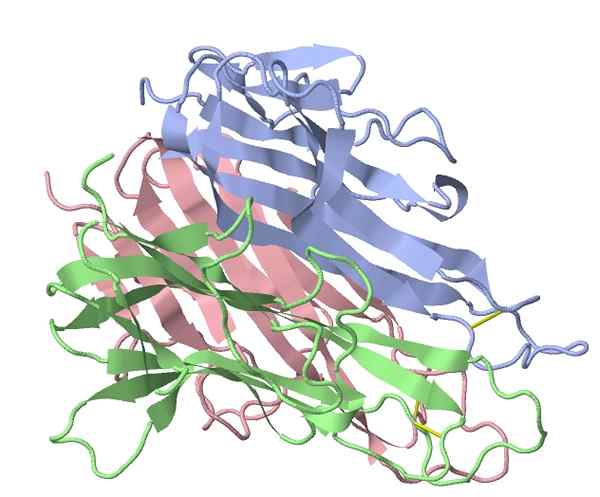
 Faktor mišjega mišjega tumorja tumorja (vir: TK Vallery/CC BY-SA (https: // createCommons.Org/licence/by-sa/3.0) prek Wikimedia Commons)
Faktor mišjega mišjega tumorja tumorja (vir: TK Vallery/CC BY-SA (https: // createCommons.Org/licence/by-sa/3.0) prek Wikimedia Commons) Leta 1975 je bil identificiran glavni "protivnetni" stimulator, ki ga aktivirajo bakterijski izvlečki, ki jih uporablja Coley, kar kaže, da je proteinski faktor v serumu zdravljenih bolnikov povzročil lizo tumorja, kjer je ime, ki identificira to skupino te skupine (TNF (TNF -α).
Približno 10 let pozneje, leta 1984, je bil gen "faktor tumorja nekroze" izoliran in označen, z istim datumom pa je bil v limfocitih T izoliran in očiščen drug podoben protein, ki se imenuje "t alfa t limfotoksin" (TLα),,,,. ki je bil pozneje znan kot faktor TNF-β.
Trenutno so opredeljeni številni beljakovini, podobni TNF, ki sestavljajo družino TNF proteinov (tumorska nekroza faktorja) in vključno z TNF-α, TNF-β proteini, ligand CD40 (CD40L), ligand FAS ( Fasl) in mnogi drugi.
[TOC]
Struktura
Na ravni genov
Gen kodiranja za protein TNF-α najdemo v kromosomu 6 (kromosom 17 pri glodalcih) in tisti, ki kodira za protein TNF-β, pred prejšnjim v obeh primerih (človeški in glodalci). Ta dva gena sta v eni kopiji in imata približno velikost 3 kb.
Glede na dejstvo, da ima zaporedje, ki ustreza promocijski regiji gena TNF-α ta dejavnik.
Promocijsko območje gena TNF-β ima na drugi strani zaporedje združevanja za drug protein, znan kot "skupina visoke mobilnosti 1" (HMG-1, iz angleščine Skupina z visoko mobilnostjo 1).
Vam lahko služi: miozin: značilnosti, struktura, vrste in funkcijeNa ravni beljakovin
Opisani sta dve obliki faktorja nekroze tumorja ALFA, ena, ki je povezana z membrano (MTNF-α) in drugo, ki je vedno topna (STNF-α). Faktor nekroze beta tumorja na drugi strani obstaja le v topni obliki (STNF-β).
Pri ljudeh membranalna oblika TNF-α je sestavljena iz polipeptida nekaj več kot 150 aminokislinskih odpadkov, ki so pritrjeni na "vodilno" zaporedje 76 dodatnih aminokislin. Ima navidezno molekulsko težo približno 26 kDa.
Premestitev tega proteina v membrano se pojavi med njegovo sintezo in ta oblika se "pretvori" v topno obliko (17 kDa) z encimom, znanim kot "pretvorni encim TNF-α", ki lahko spremeni MTNF-α v STNF -α.
Mehanizem delovanja
Beljakovine, ki pripadajo skupini faktorjev nekroze tumorja (TNF).
Obstajata dve vrsti receptorjev za beljakovine TNF v plazemskih membranah večine telesnih celic, z izjemo eritrocitov: receptorjev tipa I (TNFR-55) in receptorjev tipa II (TNFR-75).
Obe vrsti receptorjev imata strukturno homologijo glede na mesto zunajceličnega sindikata za TNF beljakovine in se tudi na njih vežeta z enakovredno afiniteto. Nato se razlikujejo na medceličnih signalnih poteh, ki se aktivirajo, ko pride do procesa vezave ligand-sprejemnika.
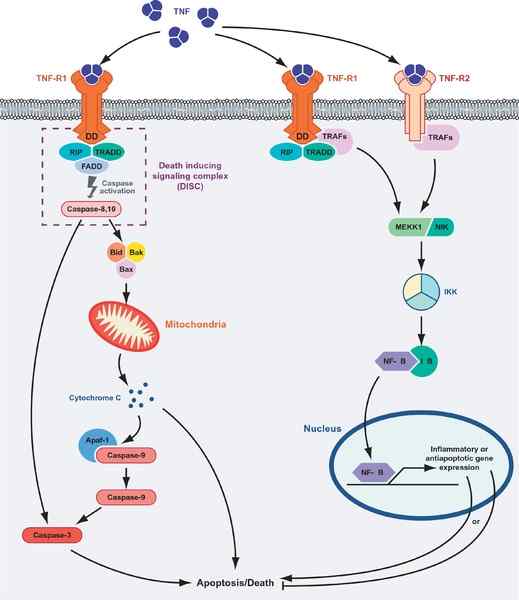 Celična smrt ali preživetje, ki jih posredujejo proteini TNF. Na levi strani grafike je prikazana apoptotična pot in pot "preživetje" (vir: masmudur m. Rahman, Grant McFadden/CC by (https: // creativeCommons.Org/licence/by/1.0) prek Wikimedia Commons)
Celična smrt ali preživetje, ki jih posredujejo proteini TNF. Na levi strani grafike je prikazana apoptotična pot in pot "preživetje" (vir: masmudur m. Rahman, Grant McFadden/CC by (https: // creativeCommons.Org/licence/by/1.0) prek Wikimedia Commons) Interakcija ligand-receptorjev TNF s katerim koli njegovim receptorjem spodbuja združitev treh receptorjev do topnega trimera TNF-α (trimerizacija receptorjev) in omenjena interakcija sproži celične odzive, tudi kadar je le 10% receptorjev zasedeni.
Zveza v receptorjih tipa I
Zveza ligand-receptorjev z receptorji tipa I služi kot "platforma za zaposlovanje" drugih signalnih beljakovin v citosolnih domenah receptorjev (notranji del). Med temi beljakovinami je prvi, ki je "dobil" TRADD ali beljakovinski protein s smrtjo domeno, povezano z receptorjem TNFR-1 (angleščina TNFR-1, povezan s smrtjo domene).
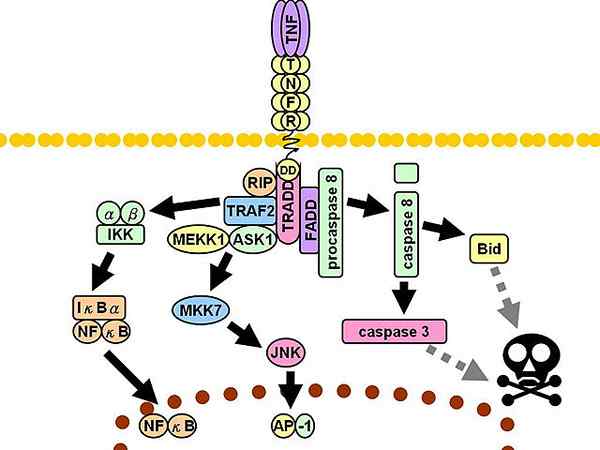 TNFR1 signalna pot. Diskontinuirane sive črte predstavljajo več korakov.
TNFR1 signalna pot. Diskontinuirane sive črte predstavljajo več korakov. Nato se zaposlijo trije dodatni mediatorji: interakcijski protein s sprejemnikom 1 (RIP1, iz angleščine PROTEIN PREDMETILA 1), Beljakovine z domeno smrti, povezane s FAS (FADD, angleščina Protein domene smrtne domene, povezane s FAS) in faktor 2, povezan s sprejemnikom TNF (TRAF2, angleščina TNF-receptorski faktor 2).
Vam lahko služi: fenilalanin: značilnosti, funkcije, biosinteza, hranaReceptorji tipa II
Ko se TNF veže na receptorje tipa II, to povzroči neposredno zaposlovanje proteina TRAF2, ki posledično zaposluje protein TRAF1. Ti proteini aktivirajo proteinske poti MAPK (iz angleščine Protein kinaza, ki se aktivira z mitogenom), zelo pomembno z vidika znotrajceličnega signalizacije v evkariotih.
Številne signalne poti, ki se aktivirajo po združitvi faktorjev TNF do njihovih receptorjev, so povezane tudi z aktiviranjem specifičnih transkripcijskih faktorjev, ki sprožijo skupne odzive, ki so bili opisani kot biološki "učinki" proteinov TNF.
Delovanje
TNF-α protein nastaja predvsem makrofagi imunskega sistema, medtem ko TNF-β protein proizvajajo T limfociti T. Vendar se je pokazalo, da tudi druge telesne celice proizvajajo te dejavnike, čeprav v manjši meri.
Faktor nekroze tumorja je bil zelo raziskan zaradi njegovih posledic v normalnih fizioloških procesih, pa tudi v akutnih in kroničnih vnetnih patoloških procesih, pri avtoimunskih boleznih in v vnetnih procesih, povezanih z različnimi vrstami raka.
Ti beljakovini so povezani s hitro izgubo teže pri bolnikih, ki trpijo zaradi akutnih bakterijskih okužb, ki trpijo zaradi raka in ki prehajajo skozi septični "spopad".
Za faktor nekroze tumorja so opisane tri različne biološke dejavnosti:
- Citotoksičnost proti tumorskim celicam
- zatiranje lipoproteinske lipaze adipocitov (LPL) in
- Zmanjšanje potenciala počitka membrane miocitov (mišične celice).
Membranalna oblika TNF-α spodbuja citotoksičnost in je bila vključena v parakrinske aktivnosti TNF v določenih tkivih.
Ko zaznamo dražljaj kot bakterijski endotoksin.
Vam lahko služi: encim: delovanje in primeriMed svojimi biološkimi funkcijami lahko proteini TNF prispevajo tudi k aktivaciji in migraciji limfocitov in levkocitov ter spodbujajo celično proliferacijo, diferenciacijo in apoptozo.
Zaviralci
Številni zdravilni zdravniki recept TNF zaviralce beljakovin pri bolnikih z avtoimunskimi boleznimi (terapija proti TNF). Med temi snovmi so: Infliximab, Etanercept, Adalimumab, Golimumab in Certolizumab Pegol.
Najpogostejša oblika uporabe je s podkožnimi injekcijami v stegnih ali trebuhu in prakticira se celo neposredna venska infuzija. Kljub temu, koliko teh snovi lahko pomagajo določenim bolnikom, obstajajo nekateri škodljivi učinki, povezani z njihovo uporabo, med katerimi se povečuje tveganje za okužbe z okužbo, kot je tuberkuloza ali druge glivične okužbe.
"Naravni" nefarmakološki zaviralci
Nekateri "rezani" fragmenti beljakovin TNF (tipa I in tipa II) so znani tudi kot TNF Union proteini (TNF-BPS, angleščina Vezavni beljakovini faktor nekroze tumor) so bili odkriti v urinu bolnikov z rakom, aidsom ali sepso.
V nekaterih primerih ti fragmenti zavirajo ali nevtralizirajo aktivnost proteinov TNF, saj se izogibajo interakciji ligand-receptorjev.
V nekaterih rastlinskih izdelkih, pridobljenih iz kurkume in granate, so odkrili druge "naravne" zaviralce beljakovin TNF, čeprav se v zvezi s tem še izvajajo študije.
Reference
- Baud, v., & Karin, m. (2001). Transdukcija signala s faktorjem nekroze tumorja in njegovih sorodnikih. Trendi v celični biologiji, 11 (9), 372–377.
- Chu, w. M. (2013). Faktor nekroza tumor. Cancer Lotters, 328 (2), 222-225.
- Kalliolias, g. D., & Ivkiv, l. B. (2016). TNF biologija, patogeni mehanizmi in nastajajoče terapevtske strategije. Nature Reviews Rheumatology, 12 (1), 49.
- Lis, k., Kuzawińska, ali., & Bałkowiec -SKRA, in. (2014). Zaviralci tumorja nekroze-faktor znanja. Arhiv medicinskih znanosti: AMS, 10 (6), 1175.
- Tracey, MD, K. J., & Cerami, ph. Daje. (1994). Faktor tumorja nekroze: pleiototropni citokin in terapevtska tarča. Letni pregled medicine, 45 (1), 491-503.
- Wu, h., & Hymowitz, s. G. (2010). Struktura in delovanje faktorja nekroze tumorja (TNF) na celični površini. V priročniku celične signalizacije (pp. 265-275). Akademski tisk.
- « Struktura kalijevega fosfata (K3PO4), lastnosti, uporablja
- Kaj je teorija zgodovine ali zgodovinologije? »

